(1)在AgNO3、Mg(NO3)2和Cu(NO3)2的混合溶液中,加入一定量的铁粉充分反应,过滤,洗涤,将滤渣放入盐酸中有气泡产生,滤液中存在的阳离子是______;
(2)在天平两端的烧杯中盛有等质量,等质量分数的盐酸,天平平衡.分别向一只烧杯中加入一定质量的镁,另一只烧杯中加入一定质量的铝,充分反应后,天平仍平衡,则加入Mg和Al的质量比是______.
解:(1)金属的活动性顺序表,铁在镁后,不可能把镁离子从溶液中置换出来,铁在银和铜的前面,因此铁可以和硝酸银、硝酸铜反应,由于将滤渣放入盐酸中有气泡产生,说明滤渣中有过量的铁,因此在滤液中不可能再有硝酸银和硝酸铜;故滤液中存在的阳离子是Fe
2+、Mg
2+;
(2)设镁的质量为x,铝的质量为y,溶液增加的质量为z.
Mg+2HCl=MgCl
2+H
2↑ 增加的质量
24 2 24-2=22
x z
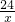
=

x=
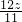
2Al+6HCl=2AlCl
3+3H
2↑ 增加的质量
54 6 54-6=48
y z
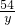
=

y=

加入镁和铝的质量比为
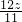
:

=32:33
故答案为:(1)Fe
2+、Mg
2+
(2)32:33
分析:理解金属活动性顺序,及灵活的运用有关的知识,加入铁粉可以置换出银与铜,滤渣中放入盐酸有气泡生成,则说明有铁的存在.天平仍然平衡,说明溶液增加的质量相等,据此可得出本题的答案.
点评:本题主要考查金属活动顺序表及有关化学方程式的计算,难度较大.关键是要将溶液增加的质量作为得到答案的桥梁.

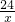 =
= x=
x=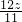
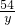 =
= y=
y=
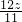 :
: =32:33
=32:33

 22、人类的生产生活离不开金属.
22、人类的生产生活离不开金属.