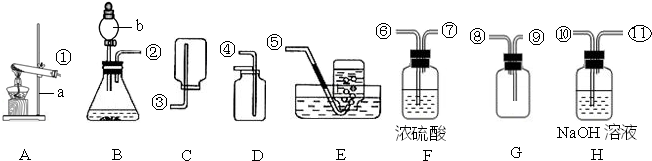
解:(1)实验室用高锰酸钾制取氧气的反应物的状态是固态,反应条件需要加热,所以可选用的发生装置是A;反应的方程式是:2KMnO
4
K
2MnO
4+MnO
2+O
2↑;
(2)产生的气体中不含酸性杂质气体,则使用的酸是稀硫酸,用G装置收集氢气,因氢气的密度比空气小,②应⑧连接,反应的化学方程式为:Zn+H
2SO
4=ZnSO
4+H
2↑;
(3)实验室用Na
2SO
3固体与稀H
2SO
4在常温下反应制取SO
2气体,属于固液在常温下反应制取气体,发生装置选B;因制备并收集一瓶干燥的SO
2气体,因此在收集之前应将二氧化硫中的水蒸气给除去,应选H装置,气体应从⑩进入;二氧化硫能溶于水,不能用排水法收集,二氧化硫的密度比空气大,应用向上排空气法收集,由因二氧化硫有毒,因而要用G装置收集,也就是把空气从上面的管口⑧排出,二氧化硫从下面的管口⑨进入;因二氧化硫有毒,为污染空气应将其除去,应选F装置,应从⑥进,总之导管的接口序号为②→⑩→
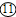
→⑨→⑧→⑥.
故答案为:(1)A;2KMnO
4
K
2MnO
4+MnO
2+O
2↑;
(2)稀硫酸;⑧;Zn+H
2SO
4=ZnSO
4+H
2↑;
(3)②→⑩→
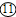
→⑨→⑧→⑥
分析:(1)根据实验室用高锰酸钾制取氧气的反应物的状态和反应条件选择发生装置;熟记反应原理;
(2)根据B装置的特点分析,制备氢气可以使用活泼金属与稀硫酸或稀盐酸反应;根据氢气的密度比空气小分析;
(3)根据制取二氧化硫气体的反应物的状态和反应条件分析发生装置,根据二氧化硫的密度和溶解性选择发生装置,再结合绿色化学的理念分析.
点评:本题考查了气体的实验室制法,要熟练掌握反应原理、发生装置的选择、收集装置的选择;另外还要能增强根据题中给出的信息解决提出的问题的能力.

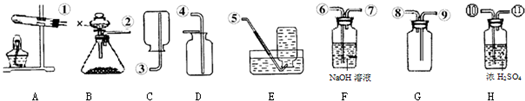
 K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;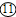 →⑨→⑧→⑥.
→⑨→⑧→⑥. K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;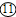 →⑨→⑧→⑥
→⑨→⑧→⑥




 →⑨→⑧→⑥
→⑨→⑧→⑥ →⑨→⑧→⑥
→⑨→⑧→⑥