
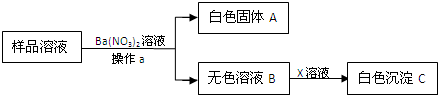


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
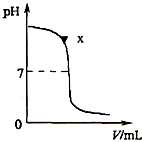 19、某兴趣小组同学对NaOH溶液与稀盐酸发生中和反应进行探究,设计了如下实验:同学们把两种无色溶液分别贴上A、B标签,向烧杯中倒入一定量的A溶液并测定其pH,再向溶液中逐滴加入B溶液,并不断振荡,同时测定混合液的pH,pH变化情况如图.
19、某兴趣小组同学对NaOH溶液与稀盐酸发生中和反应进行探究,设计了如下实验:同学们把两种无色溶液分别贴上A、B标签,向烧杯中倒入一定量的A溶液并测定其pH,再向溶液中逐滴加入B溶液,并不断振荡,同时测定混合液的pH,pH变化情况如图.查看答案和解析>>
科目:初中化学 来源: 题型:
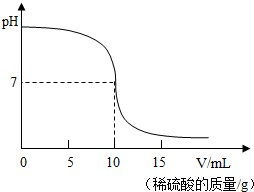 (2013?张家港市模拟)利用中和反应可以测定酸或碱溶液中溶质的质量分数.下图为某次测定过程中,溶液的pH随所滴加的某标准溶液体积的变化而变化的关系图.
(2013?张家港市模拟)利用中和反应可以测定酸或碱溶液中溶质的质量分数.下图为某次测定过程中,溶液的pH随所滴加的某标准溶液体积的变化而变化的关系图.查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 学生探究 | 实验过程 | 实验现象 | 结论 |
| 方案① |  |
加入氢氧化钠溶液后,温度明显上升. | 测量温度变化可以证明稀硫酸与氢氧化钠溶液能发生反应 |
| 方案② |  |
出现白色沉淀 | 用氯化钡溶液可以证明稀硫酸与氢氧化钠溶液能发生反应 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com