
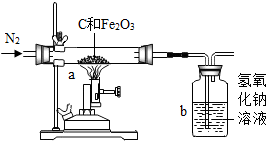
分析 氢氧化钠溶液能够吸收二氧化碳,并且能和二氧化碳反应生成碳酸钠和水;
碳在高温条件下和氧化铁反应时可能生成二氧化碳,也可能生成一氧化碳,也可能生成二氧化碳和一氧化碳;
氧化铁和稀盐酸反应生成氯化铁和水,根据滤渣质量可以计算氧化铁的质量,进一步可以计算计算赤铁矿中氧化铁的质量分数和所用盐酸中溶质的质量分数.
解答 解:(1)实验中持续通入干燥氮气.加热前缓缓通入氮气一段时间,其作用是排出装置中的二氧化碳.
故填:排出装置中的二氧化碳.
(2)因为反应结束后应该一直通入氮气直至试管冷却,所以停止加热前不需要先断开a和b的连接.
故填:不需要,因为反应结束后应该一直通入氮气直至试管冷却.
(3)A.碳和氧化铁反应可能生成CO,从而导致生成二氧化碳的质量偏小,进一步导致测定的氧化铁质量分数偏小;
B.氮气在排出时可能带出水蒸气,从而导致计算的二氧化碳质量偏小,进一步导致测定的氧化铁质量分数偏小;
C.b装置吸收右侧空气中的二氧化碳时,会导致计算的二氧化碳质量偏答,进一步导致测定的氧化铁质量分数偏大.
故填:偏小;AB.
设稀盐酸中氯化氢的质量为x,
氧化铁的质量为:10g-2g=8g,
Fe2O3+6HCl═2FeCl3+3H2O,
160 219
8g x
$\frac{160}{8g}$=$\frac{219}{x}$,
x=10.95g,
赤铁矿中氧化铁的质量分数为:$\frac{8g}{10g}$×100%=80%,
所用盐酸中溶质的质量分数为:$\frac{10.95g}{100g}$×100%=10.95%,
答:赤铁矿中氧化铁的质量分数为80%,所用盐酸中溶质的质量分数为10.95%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
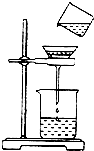 如图是明明同学将浑浊的河水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会儿,进行过滤的操作.
如图是明明同学将浑浊的河水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会儿,进行过滤的操作.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 南京第二届夏季青奥会上,中国代表团获得金银铜奖牌共计63枚.
南京第二届夏季青奥会上,中国代表团获得金银铜奖牌共计63枚.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 聚乙烯和聚氯乙烯都可以包装食品 | |
| B. | 红磷在空气中燃烧产生大量的白烟 | |
| C. | 普通玻璃和有机玻璃都属于无机非金属材料 | |
| D. | 铁加入稀硫酸中得到黄色溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
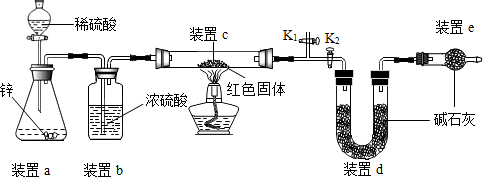
| 实验操作 | 实验现象 | 实验结论 |
| 取少量红色固体加入到足量稀硫酸溶液中 | 若无明显现象 | 假设1成立 |
| 若固体部分(选填“全部”或“部分”)溶解,溶液由无色变蓝色 | 假设2和假设3均成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
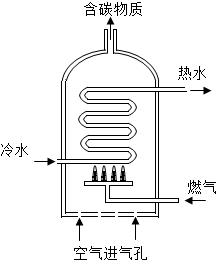 通过化学学习,同学们对物质的组成、结构、性质及用途有了一定的了解.
通过化学学习,同学们对物质的组成、结构、性质及用途有了一定的了解.| 燃料 | 相关燃烧产物的质量/g | |
| CO2 | SO2 | |
| 汽油 | 2900 | 5.0 |
| 天然气 | 2500 | 0.1 |
| 煤 | 2500 | 11.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
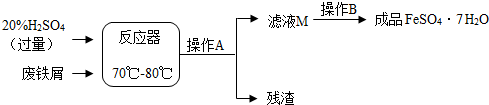
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 | |
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 | |
| 析出 晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | ||||||||
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 编号 | 实验事实 | 实验结论 |
| A | 把燃着的木条伸入盛有某无色气体的集气瓶中,火焰熄灭 | 该气体一定是二氧化碳 |
| B | 向某无色溶液滴入无色酚酞溶液,呈红色 | 该溶液一定是碱溶液 |
| C | 向某物质中加入稀盐酸,产生气泡 | 该物质一定是碳酸盐 |
| D | 常温下,测得某溶液的pH=0 | 该溶液一定显酸性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com