解:根据质量守恒定律,生成二氧化碳气体的质量=73g+11g+20.4g-100g=4.4g;
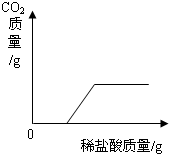
(1)如右图:
(2)反应的化学方程式为:
Na
2CO
3+HCl=NaHCO
3+NaCl
NaHCO
3+HCl=NaCl+CO
2↑+H
2O
设样品中Na
2CO
3的质量为x,
∴Na
2CO
3----CO
2
106 44
x 4.4g
∴
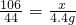
,
解之得:x=10.6g;
则样品中NaCl和Na
2CO
3的质量比为:(11g-10.6g):10.6g=2:53;
(3)①设碳酸钠与盐酸反应生成的氯化钠的质量为y,
Na
2CO
3+HCl=NaHCO
3+NaCl
106 58.5
10.6g y
∴
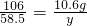
,
解之得:y=5.85g;
②设碳酸氢钠与盐酸反应生成的氯化钠质量为z,
NaHCO
3+HCl=NaCl+CO
2↑+H
2O
58.5 44
z 4.4g
∴
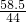
=
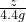
,
解之得:z=5.85g;
则恰好完全反应时所得溶液的溶质质量分数为:
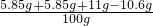
×100%=12.1%.
答:(2)样品中NaCl和Na
2CO
3的质量比为2:53;
(3)恰好完全反应时所得溶液的溶质质量分数为12.1%.
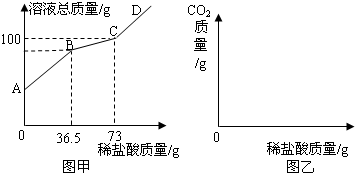
分析:(1)盐酸首先与碳酸钠反应,没有二氧化碳产生,然后与碳酸氢钠反应,生成二氧化碳的质量随滴入盐酸质量的增加而增加,当完全反应时,气体不再生成;
(2)因为盐酸与氯化钠不反应,分析图示数据可知,AB段表示盐酸与碳酸钠反应,BC段表示盐酸与碳酸氢钠反应.根据质量守恒定律,生成二氧化碳气体的质量=反应前物质质量总和-反应后物质质量总和;根据化学方程式可知,完全反应的情况下,参与反应的碳酸钠质量与生成的碳酸氢钠质量成正比例,碳酸氢钠质量与二氧化碳质量成正比例,由此推断,碳酸钠质量与二氧化碳质量成正比例,据此计算出碳酸钠的质量;样品质量-碳酸钠质量=氯化钠质量,进而得出样品中NaCl和Na
2CO
3的质量比;
(3)分析题意可知,恰好完全反应时所得溶液的溶质是氯化钠(包括样品中的氯化钠、碳酸钠与盐酸反应生成的氯化钠和碳酸氢钠与盐酸反应生成的氯化钠),然后根据溶质质量分数公式计算即可.
点评:本题主要考查学生利用化学方程式和质量守恒定律进行计算的能力.本题所涉数据较多,学生需认真分析数量关系,找出数据之间的联系,根据质量守恒定律,得出生成二氧化碳的质量,就可以顺利答题.

 解:根据质量守恒定律,生成二氧化碳气体的质量=73g+11g+20.4g-100g=4.4g;
解:根据质量守恒定律,生成二氧化碳气体的质量=73g+11g+20.4g-100g=4.4g;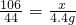 ,
,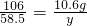 ,
,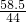 =
=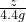 ,
,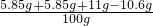 ×100%=12.1%.
×100%=12.1%.
