
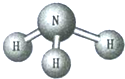
| A. | 化学式为NH3 | B. | 属于混合物 | ||
| C. | 氮元素和氢元素的质量比为3:1 | D. | 氢元素的质量分数$\frac{1}{17}$×100%=5.9% |
分析 A、根据某物质的分子模型,一个分子是由1个氮原子和3个氢原子构成的,其化学式为:NH3进行分析;
B、根据分子模型可以看出,该物质是由氨分子组成的纯净物进行分析;
C、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断;
D、根据化合物中元素的质量分数为:$\frac{相对原子质量×原子个数}{相对分子质量}$×100%,进行分析判断.
解答 解:A、由某物质的分子模型,一个分子是由1个氮原子和3个氢原子构成的,其化学式为:NH3,故A正确;
B、由分子模型可以看出,该物质是由氨分子组成的纯净物,故B错误;
C、氮元素和氢元素的质量比为(12×2):(1×6)≠3:1,故C错误;
D、氢元素的质量分数为:$\frac{1×3}{14+1×3}$×100%≈17.6%,故D错误.
故选:A.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | t1℃甲、乙的饱和溶液升温到t2℃,变成不饱和溶液,溶质质量分数相等 | |
| B. | t2℃等质量的甲、乙溶液蒸发等质量的水,甲析出晶体多 | |
| C. | 甲中混有少量乙时,可以用蒸发的方法获得较纯净的乙 | |
| D. | t2℃等质量的甲、乙的饱和溶液降低温度到t1℃后溶液的质量相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 温室里施用二氧化碳对植物生长不利 | |
| B. | 用紫色石蕊溶液可区分CO和CO2 | |
| C. | 金刚石、石墨、C60都是碳原子构成的,所以性质相同 | |
| D. | 在2CuO+C$\frac{\underline{\;高温\;}}{\;}$ 2Cu+CO2↑的反应中,CuO是还原剂,具还原性 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

 ②氯化钠溶液能导电;乙醇溶液不能导电.
②氯化钠溶液能导电;乙醇溶液不能导电.| 影响因素 | 实验设计 | 实验现象 | 实验结论及解释 |
| ①温度 | 将装置I放入25℃恒温环境中,装置II放入40℃恒温环境中. | 两套装置中铁钉均锈蚀,且U型管中液面均由b处上升至a处,则所需时间I>II. | 锈蚀的速率I<II;铁的锈蚀速率与反应时的温度有关,温度越高,锈蚀速率越快. |
| ②氧气含量 | 在相同温度下,装置I中充满氧气,装置II中充满空气 | 两套装置中铁钉均锈蚀,且U型管中液面均由b处上升至a处,则所需时间I<II | 铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快. |
| ③水溶液的导电性 | 在相同温度下,装置I集气瓶中加入10mL氯化钠溶液;装置II集气瓶中加入10mL乙醇. | 两套装置中铁钉均锈蚀;且U型管中液面均由b处上升至a处,则所需时间I<II. | 铁的锈蚀速率与溶液是否导电有关,溶液导电性越强,铁的锈蚀速率越快 |

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com