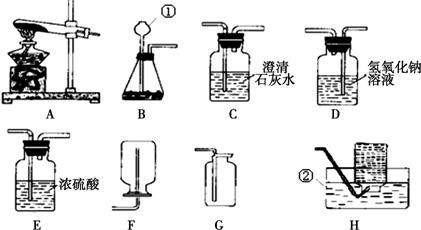
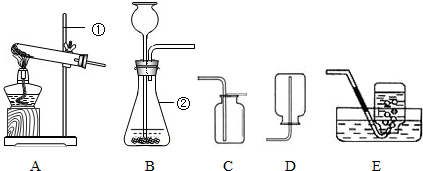
解:(1)图中①是试管,②是长颈漏斗,故答案为:试管;长颈漏斗;
(2)用高锰酸钾制取氧气需要加热,所以发生装置可选A或B,但A装置中试管口缺少一团棉花,故选B.
故答案为:B.
(3)实验室用稀盐酸与碳酸钙的反应制取二氧化碳,化学反应式是:CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑,此反应属于两种化合物相互交换成分,生成另外两种化合物的复分解反应;制取干燥的二氧化碳需要干燥装置,所以选有浓硫酸的装置,收集装置要用向上排空气法.故选CDE;二氧化碳的验满可根据它不支持燃烧的特点,将燃着的木条放在集气瓶口,木条熄灭说明已满.
故答案为:CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;复分解反应;CDE;将燃着的木条放在集气瓶口,木条熄灭说明已满;
(4)①联系物理中学过的控制变量法,根据实验a和b探究同体积下HCl质量分数对该反应剧烈程度的影响,就可以得出其温度和大理石规格应该是控制相同的;所以,实验b中的空缺应该分别是25、粗颗粒和9.125%.同理,实验d中的空缺应该分别是25、细颗粒和18.25%.即
| 实验编号 | T/℃ | 大理石规格 | HCl的质量分数 |
| b | 25 | 粗口颗粒 | 9.125% |
| d | 25 | 细颗粒 | 18.25% |
②根据实验a和b探究时间(即160s和210s)可知,实验a比b用时少;这就说明了实验a比b反应剧烈.也就不难得出:在其他条件不变时,盐酸质量分数越大,反应越剧烈.同理可得,在其他条件不变时,温度越高,反应越剧烈;固体的颗粒越小,反应越剧烈.所以,该实验结论应该是:在其他条件不变时,盐酸质量分数越大,反应越剧烈;温度越高,反应越剧烈;固体的颗粒越小,反应越剧烈.
分析:(1)熟悉常见仪器,了解名称;
(2)根据高锰酸钾制氧气需要加热选择发生装置;
(3)实验室制取二氧化碳用稀盐酸与碳酸钙反应,制取干燥的二氧化碳只需加一个干燥装置;根据二氧化碳不支持燃烧的性质验满;
(4)②联系物理中学过的控制变量法,根据实验设计方案中的实验目的(Ⅰ)实验a和b探究同体积下HCl质量分数对该反应剧烈程度的影响,就可以得出其温度和大理石规格应该是控制相同的;所以,实验b中的空缺应该分别是25、粗颗粒和9.125%.同理,实验d中的空缺应该分别是25、细颗粒和18.25%.
③根据ab盐酸质量分数的不同导致用时的不同;ac温度的不同导致用时不同;ad颗粒大小的不同导致用时不同考虑实验结论.
点评:此题是综合性很强的一道题,考查的点多面广.它不但考查了影响化学反应速率的因素,还考查了有关的化学方程式的书写,更考查了根据有关的实验数据推导的能力.解答此类题目时,只有抓住实验目的,结合物理中学过的控制变量法,进行细致的思考、推断,才可达到柳暗花明又一村的理想境界,最终准确无误地解答出各个问题.




 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案