
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Ni2+ | 6.7 | 9.5 |
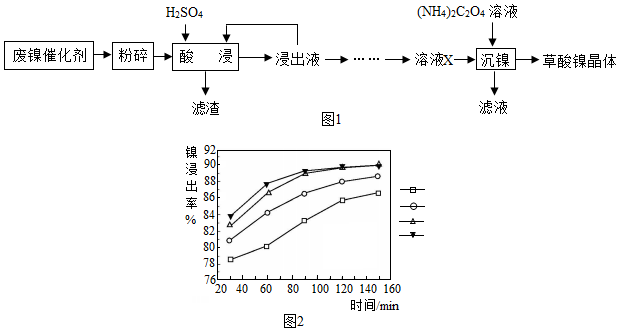
分析 (1)反应物接触面积越大,反应速率越快;
(2)根据图2中的信息,可以判断“酸浸”的适宜温度与时间;
(3)“酸浸”过程中,氧化铁和稀硫酸反应生成硫酸铁和水,属于复分解反应;
(4)“浸出液”得到“溶液x”过程中,加入试剂先后顺序是:先加H2O2溶液把亚铁离子氧化成铁离子,再加NaOH溶液;
根据表中提供的信息可以判断加NaOH溶液调节pH的范围;
充分反应后得到滤渣的操作是过滤,该操作中所用到的玻璃仪器有玻璃棒、烧杯和漏斗;
(5)将“沉镍”工序:①主要过程为:蒸发浓缩、降温结晶、过滤,所得固体用75%乙醇洗涤、110℃下烘干,得草酸镍晶体;
草酸镍晶体不溶于75%乙醇溶液;
③温度过高时草酸镍晶体容易失去结晶水.
解答 解:(1)废镍催化剂“粉碎”的目的是增大与硫酸的接触面积,加快反应速率.
故填:增大与硫酸的接触面积,加快反应速率.
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图2,由图2提供的信息可知,“酸浸”的适宜温度与时间分别为
70℃、120min因为这时镍浸出率最高.
故填:C.
(3)“酸浸”过程中,氧化铁和稀硫酸反应生成硫酸铁和水,属于复分解反应,发生的复分解反应方程式为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.
故填:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.
(4)“浸出液”得到“溶液x”过程中,加入试剂先后顺序是先加H2O2溶液把亚铁离子氧化成铁离子,再加NaOH溶液;
加NaOH溶液调节pH为3.2~6.7时,铁离子和亚铁离子能够完全以沉淀析出,而镍离子不能形成沉淀;
充分反应后得到滤渣的操作是过滤,该操作中所用到的玻璃仪器有玻璃棒、烧杯和漏斗.
故填:A;3.2~6.7;过滤;漏斗.
(5)将“沉镍”工序:①主要过程为:蒸发浓缩、降温结晶、过滤,所得固体用75%乙醇洗涤、110℃下烘干,得草酸镍晶体;
②用75%乙醇洗涤的目的是洗去杂质、减少草酸镍晶体的损失;
③烘干温度不超过110℃的原因是防止草酸镍失去结晶水.
故填:降温结晶;减少草酸镍晶体的损失;防止草酸镍失去结晶水.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:选择题
| A. | 有机物是一类含碳化合物,所以CH4、CO2都是有机物 | |
| B. | 硫酸、盐酸电离时都能产生H+,所以电离能产生H+的化合物是酸 | |
| C. | 金属Fe、Zn能与酸反应生成氢气,所以金属都能与酸反应生成氢气 | |
| D. | 氧化物是由两种元素组成,其中一种是氧元素的化合物,所以水是氧化物 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 葡萄糖是由碳、氢气和氧气组成 | B. | 葡萄糖由三种元素组成 | ||
| C. | 葡萄糖由24个原子构成 | D. | 葡萄糖分子由碳原子和水分子构成 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 Cl-、
Cl-、 H+、
H+、 Cu2+
Cu2+
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
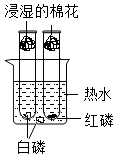 小徐根据如图实验装置进行可燃物燃烧条件的探究,有关该实验和装置的分析合理的是( )
小徐根据如图实验装置进行可燃物燃烧条件的探究,有关该实验和装置的分析合理的是( )| A. | 烧杯中的热水只能起到升高可燃物温度的作用 | |
| B. | 湿棉花的作用是防止空气中的CO2进入试管 | |
| C. | 试管内外的白磷现象不同,因为其着火点不同 | |
| D. | 对实验的分析可以得出可燃物燃烧所需的条件 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | O2具有助燃性,而CO2可用来灭火 | |
| B. | 空气中O2过多无害,而CO2过多会形成酸雨 | |
| C. | 它们都可用向上排空气法收集 | |
| D. | 自然界里它们可通过光合作用和呼吸作用相互转化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com