
某同学研究化学反应时,发现高锰酸钾受热分解后剩余固体的质量比反应前的质量小,镁条燃烧后的固体质量比反应前的质量大,因此他认为有些化学反应遵守质量守恒定律,有些反应就不一定遵守了,你认为这样的结论正确吗?
|
该同学得出的结论不正确,所有的化学反应都应符合质量守恒定律,即参加反应的高锰酸钾的质量等于反应后生成的锰酸钾、二氧化锰和氧气的质量之和;参加反应的镁条和氧气的质量之和等于反应后生成的氧化镁的质量. 解答此题,必须把握质量守恒定律的本质,即在一切化学反应中,化学变化前后原子种类、原子数目、原子质量不变,所以上面的两个反应都遵守质量守恒定律.高锰酸钾受热分解后生成了锰酸钾、二氧化锰、氧气,剩余的固体只是锰酸钾和二氧化锰.没有把氧气的质量计算在内,所以质量比高锰酸钾小了.如果把生成的氧气质量计算在内,那么反应前后的质量就相等了.镁条燃烧后的固体是氧化镁,氧化镁的质量应等于镁条质量加上与镁反应的氧气的质量,所以镁条燃烧后的固体质量比反应前镁条的质量增加了. |
|
该同学认为不符合质量守恒定律的原因是忽视了反应中那种不易察觉的物质椘  
练习册系列答案
 名校课堂系列答案 名校课堂系列答案
相关习题
科目:初中化学 来源: 题型:阅读理解 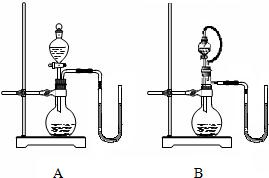 28、物质之间发生化学反应时,常伴随有明显的现象,但有些化学反应却观察不到明显的现象.某班同学为证明NaOH能与稀盐酸发生中和反应,从不同角度设计了如下实验方案,并进行实验. 28、物质之间发生化学反应时,常伴随有明显的现象,但有些化学反应却观察不到明显的现象.某班同学为证明NaOH能与稀盐酸发生中和反应,从不同角度设计了如下实验方案,并进行实验.【方案一】:先在NaOH稀溶液中滴加几滴酚酞试液,溶液显 红 色,然后再滴加盐酸,当观察到红色褪去 ,证明NaOH溶液与稀盐酸发生了化学反应.当得到无色溶液时,小虎认为这时酸与碱恰好完全反应.小英却认为这时还应该存在的另一种情况是盐酸过量 .接着老师又提出问题:红色消失一定证明是酸与碱发生中和反应吗?他们经过讨论认为也可能是酚酞与酸反应而褪色.这时应在溶液中再滴加酚酞(或氢氧化钠溶液) 溶液,若有不变红(或变红) 现象,则证明不是酚酞与酸反应而褪色.【方案二】:用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应.这时小虎又提出疑问:pH逐渐变小,可能是由于溶液稀释造成的,不能说明一定发生了反应.小全对小虎的疑问进行了反驳,他的理由是: 碱溶液无论如何稀释,其pH值都不可能小于7 .测定溶液的pH时,需在白瓷板或玻璃片上放一小片pH试纸,用 滴管或玻璃棒 把待测液滴在pH试纸上,过一会儿,将试纸的颜色与标准比色卡 比较,从而得出溶液的pH.若对一未知溶液用湿润的pH试纸来测定溶液的pH,则测定的结果会D .A.偏大,B.偏小,C.不变,D.以上三种可能都有 【方案三】:在试管中放入一粒NaOH固体,然后加入稀盐酸. 小华看到氢氧化钠固体消失了,认为发生了反应.而小全想了想之后却不同意小华的观点,小全的理由是: 可能是氢氧化钠溶于水 .小明用手摸了摸试管外壁,试管比较热,他认为不仅说明它们发生了反应,而且是放热反应.小全思考之后仍然不同意小明的观点,小全的理由是:氢氧化钠溶于水也放热 .乙同学和丙同学各设计了一个装置(见右图),都说在不使用温度计的情况下可以判断NaOH溶液与稀盐酸发生了中和反应.分析说明: B (填序号)装置更合理,理由是B装置能排除因液体的滴入而造成烧瓶内气体排出,引起玻璃管内液面发生变化 .若选用合理的装置进行实验,当出现玻璃管中左侧液面下降,右侧液面上升 现象时,可以说明NaOH溶液与稀盐酸发生了反应.【方案四】:可以通过测定反应前的物质不存在来判断反应的发生.将一定量的稀盐酸溶液平均分为两份,一份直接加入锌粒中,观察到的现象是 有气泡产生 ;向另一份中先加入过量的NaOH溶液,再加入锌粒中,观察到无气泡产生 现象,说明NaOH溶液和HCl溶液发生了反应.锌粒与稀盐酸反应的化学方程式为Zn+2HCl═ZnCl2+H2↑ .【方案五】:定量研究是化学研究中的一种重要的方法.一同学将200 mL稀盐酸平均分成两份,其中一份直接加入到w g的CaCO3中,充分反应后收集到V1体积的CO2;向另一份中先滴加一定量的NaOH溶液,充分反应后,也加入到w g的CaCO3中,反应后收集到V2体积的CO2.如果V1 > V2(填“>”或“<”或“=”)也能说明NaOH溶液和HCl溶液发生了反应.查看答案和解析>> 科目:初中化学 来源: 题型:038 某同学研究化学反应时,发现高锰酸钾受热分解后剩余固体的质量比反应前的质量小,镁条燃烧后的固体质量比反应前的质量大,因此他认为有些化学反应遵守质量守恒定律,有些反应就不一定遵守了,你认为这样的结论正确吗? 查看答案和解析>> 科目:初中化学 来源: 题型:填空题
|