6.5g锌与100g稀硫酸恰好完全反应.
(1)在100g稀硫酸中,溶质的化学式为______,其质量为______g;溶剂的化学式为______,其质量为______g.
(2)完全反应后,所得溶液的质量为______g.其中溶质的化学式为______,其质量为______g;溶剂的化学式为______,其质量为______g.
解:(1)稀硫酸中溶质是H
2SO
4 溶剂是水,
设参加反应的H
2SO
4的质量为x
Zn+H
2SO
4=ZnSO
4+H
2↑
65 98
6.5g x
∴
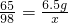
解之得x=9.8g
根据溶剂的质量=溶液的质量-溶质的质量知道,溶剂 H
2O的质量=100g-9.8g=90.2g
故答案为:H
2SO
4 9.8 H
2O 90.2
(2)反应后,所得溶液的质量等于锌的质量+稀硫酸的质量-反应后生成的氢气的质量,
溶质的化学式为ZnSO
4设反应后生成的氢气的质量为y,生成的ZnSO
4的质量为z
Zn+H
2SO
4=ZnSO
4+H
2↑
65 161 2
6.5g z y

解得:y=0.2g z=16.1g
反应后,所得溶液的质量=锌的质量+稀硫酸的质量-反应后生成的氢气的质量
=6.5g+100g-0.2g=106.3g
根据溶剂的质量=溶液的质量-溶质的质量知道,
溶剂的质量=106.3g-16.1g=90.2g
答:这种硫酸的溶质质量是9.8g
故答案为;106.3g ZnSO
4 16.1g H
2O 90.2
分析:稀硫酸中溶质是H
2SO
4 溶剂是水,锌与稀硫酸反应生成硫酸锌与氢气,欲求这种硫酸的溶质质量,需要根据参加反应的锌的质量来求,然后根据溶剂的质量=溶液的质量-溶质的质量来求溶剂的质量.
点评:本题主要考查学生对有关化学方程式的计算能力.学生需正确书写出化学方程式,并能正确运用反应物与生成物间的质量关系进行计算,才能正确答题.




 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 某化学兴趣小组需要用溶质质量分数为19.6%的稀硫酸和锌粒反应来制取氢气,实验室现有一瓶浓硫酸,标签如右图.
某化学兴趣小组需要用溶质质量分数为19.6%的稀硫酸和锌粒反应来制取氢气,实验室现有一瓶浓硫酸,标签如右图.
