
分析 虽然生石灰遇水会放出大量热而使饱和溶液溶液升高,但题中明确“恢复到原来的温度”,因此在分析本问题时不需要考虑温度对溶液的影响;由于氧化钙能与水发生反应生成氢氧化钙,易被误解为增加了溶液中的溶质,其实,则于氧化钙反应消耗了饱和溶液中的水,而使饱和溶液因减少溶剂水而析出固体,饱和溶液的溶质、溶剂质量同时减少,溶液仍为饱和溶液.
解答 解:由于氧化钙与饱和溶液中的水发生反应而使溶液因此减少了水,饱和溶液的溶剂减少会造成溶质析出;溶液的溶质、溶剂都在减少,溶液的质量也减小;固体物质的溶解度只受温度的影响,由于溶液的温度不变,因此,溶液的溶解度也不变.根据相同温度下的同种溶质的饱和溶液的溶质质量分数相同,饱和溶液的溶质质量分数不变;
故答案是:变小;变小;变小;不变.
点评 全面分析影响饱和溶液的各种因素,是正确处理有关饱和溶液发生改变类问题的关键,可以体现思维的严密性.


 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:初中化学 来源: 题型:解答题
 某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.
某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.| 实验操作 | 实验现象及结论 |
| 实验序号 | 实验1 | 实验2 | 实验3 | / |
| 与镁条反应的溶液 | NH4Cl | NaCl | Na2SO4l | H2O |
| 实验现象 | 有大量气泡产生 | 有较多气泡产生 | 有少量气泡产生 | 气泡极少 |
| 加热后,实验现象 | 气泡明显增多可闻到氨味 | 气泡增多 | 气泡增多 | 气泡增多 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
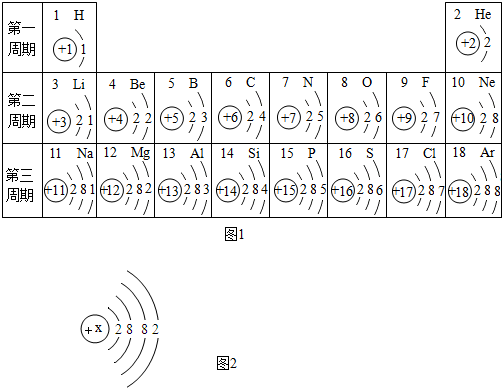
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Na2CO3、H2SO4、HCl、KNO3 | B. | CuSO4、KOH、NaCl、NaOH | ||
| C. | Na2SO4、Na2CO3、BaCl2、HNO3 | D. | NaNO3、MgCl2、KCl、Ba(OH)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com