
一化学兴趣小组对某生铁样品中铁的质量分数进行探究.请按要求完成下列探究报告.
【实验目的】
测定某生铁样品中单质铁的质量分数.
【资料支撑】
生铁中除铁外,还含有碳、硅、锰、磷和硫等元素.碳在生铁中以两种形态存在,一种是游离碳(石墨),另一种是化合碳(如Fe3C等);硅、锰、磷、硫存在形式较为复杂;这些物质通常都不与稀硫酸发生化学反应.
【实验方案】
生铁样品与过量的稀硫酸反应,测定反应前后可称量物质的质量差.
【实验过程】
(1)取一只烧杯,称得其质量为70.4g,加入一定量生铁样品碎屑,称得烧杯和样品的总质量为102.4g;
(2)向盛有生铁样品的烧杯中加入稀硫酸,边加边搅拌,直到烧杯中不再产生气泡,再加入少量稀硫酸以确保过量,测得共用去稀硫酸247.3g;
(3)静置,称量.称得烧杯和剩余物质的总质量为348.7g.
【数据处理】计算该生铁样品中单质铁的质量分数是多少?(写出计算过程)
【交流讨论】
(1)实验称量时称量物应放在托盘天平的 盘(选填“左”或“右”);
(2)实验过程中稀硫酸要过量的原因是 ;
(3)经质检部门精确测定,该样品中铁元素的总含量为95.2%.假设没有与硫酸反应的铁都以Fe3C形式存在,则样品中Fe3C的质量分数为 .
| 烧杯中减少的质量是生成氢气的质量,根据铁与稀硫酸反应的化学方程式可以计算出样品中单质铁的质量.进而计算出样品中单质铁的质量分数. 由样品质量和样品中铁元素的质量分数,可以计算出样品中铁元素的总质量,去掉单质铁的质量,就是没有与稀硫酸反应的铁元素的质量,根据物质中某元素的质量分数的计算公式可以计算出样品中Fe3C的质量,进而计算出样品中Fe3C的质量分数. | |
| 解答: | 解:生成氢气的质量为102.4g+247.3g﹣348.7g=1g 设样品中单质铁的质量为x. Fe+H2SO4=FeSO4+H2↑ 56 2 x 1g
样品中单质铁的质量分数为
称量是物品放在天平的左盘,砝码放在天平的右盘. (3)设样品质量为100g,则样品中铁元素的总质量为 100g×95.2%=95.2g. 铁单质的质量为100g×87.5%=87.5g 样品中Fe3C的铁元素质量为95.2g﹣87.5g=7.7g 7.7g÷( 样品中Fe3C的质量分数为
答:生铁样品中单质铁的质量分数为87.5% (1)左;(2)确保生铁样品中铁单质与稀硫酸完全反应;(3)8.25%. |


 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 结论 |
| ①取少量固体样品溶于水中 | 溶液澄清 | |
| ② 取①中少量溶液加入盐酸 取①中少量溶液加入盐酸 . |
有气泡 有气泡 . |
猜想二正确 化学方程式为: Na2CO3+2HCl=2NaCl+H2O+CO2↑ Na2CO3+2HCl=2NaCl+H2O+CO2↑ . |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
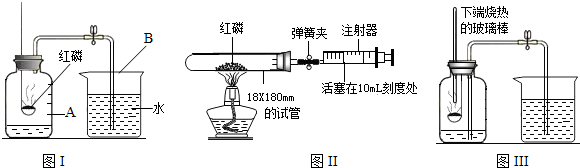
| 点燃 |
| 点燃 |
| 1 |
| 5 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
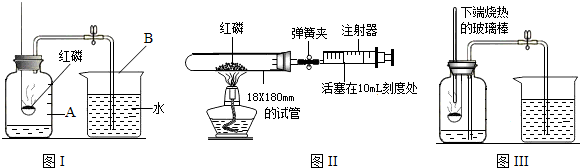
 ,你认为导致这一结果的原因是________.(只需写一点)
,你认为导致这一结果的原因是________.(只需写一点)查看答案和解析>>
科目:初中化学 来源:东城区二模 题型:问答题
| 实验步骤 | 实验现象 | 结论 |
| ①取少量固体样品溶于水中 | 溶液澄清 | |
| ②______. | ______. | 猜想二正确 化学方程式为:______. |
查看答案和解析>>
科目:初中化学 来源:北京模拟题 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com