解:(1)根据图中标签可以知道4t 浓硫酸所含纯硫酸的质量为:4t×98%=3.92t
(2)设能够配制溶质质量分数为19.6%的稀硫酸的质量为x
x?19.6%=3.92t
解得:x=20t
(3)设能够制得硫酸锌的质量为y
Zn+H
2SO
4═ZnSO
4+H
2↑
98 164
3.92t y
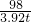
=
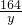
解得:y=6.56t
答:(2)上述的浓硫酸能够配制20吨溶质质量分数为19.6%的稀硫酸?
(3)能制的硫酸锌的质量是6.56t.
故答案为:(1)3.92;
(2)20t;
(3)6.56t.
分析:(1)根据标签中所给的信息可以知道该浓硫酸的浓度为98%,可以据此结合溶液中溶质的质量;
(2)根据溶液稀释前后溶液中溶质的质量不变进行解答即可;
(3)根据硫酸的质量结合反应的化学方程式可以计算出生成的硫酸锌的质量.
点评:本题考查学生利用化学方程式的计算,学生应注意通过信息抽取解题所需要的信息,能正确运用说明书中物质的质量,并能够正确的书写化学方程式找出已知量进行求算.

 某工厂购买4t浓硫酸,其标签如图所示,请根据有关信息回答问题.
某工厂购买4t浓硫酸,其标签如图所示,请根据有关信息回答问题.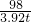 =
=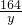


 某工厂购买4t浓硫酸,其标签如图所示,请根据有关信息回答问题.
某工厂购买4t浓硫酸,其标签如图所示,请根据有关信息回答问题.