
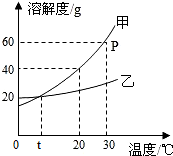
 如图是甲、乙两种固体物质的溶解度曲线.据图回答:
如图是甲、乙两种固体物质的溶解度曲线.据图回答:分析 (1)根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小;
(2)饱和溶液和不饱和溶液之间可以相互转化;据溶解度曲线可知物质的溶解度随温度变化情况,并分析提纯物质的方法;
(3)据溶解度曲线可知某温度下物质的溶解度,并计算溶质的质量分数,升温过程中溶剂的质量不变;
(4)据溶解度曲线还可比较同一温度下物质的溶解度大小等.
解答 解:(1)P点表示30℃时,甲的溶解度是60g;
(2)甲的溶解度随着温度的升高而增大,要使接近饱和的甲溶液变成饱和溶液,可采用的方法有增加溶质、降低温度等;
甲的溶解度受温度变化影响大,乙的溶解度受温度变化影响小,因此当甲中含有少量乙时,可采用降温结晶或冷却热饱和溶液的方法提纯甲;
(3)30℃时,甲的溶解度是60g,即100g水中最多溶解60g的甲,所以将40g甲物质放入盛有50g水的烧杯中,只能够溶解30g,所得溶液溶质的质量分数为:$\frac{30g}{80g}$×100%=37.5%;
若烧杯内物质升温到50℃(不考虑蒸发 ),甲的溶解度增大,则剩余溶质会继续溶解,溶液中溶质的质量增大,溶液的质量增大,溶质的质量分数增大,而溶剂质量不变;
(4)从图中还可获得的信息有:t℃时,甲和乙的溶解度相等,温度小于t℃时,乙的溶解度大于甲的溶解度等;
故答案为:(1)30℃时,甲的溶解度是60g;
(2)加入甲物质(合理均可);降温结晶(或冷却热饱和溶液);
(3)37.5%;bc;
(4)t℃时,甲和乙的溶解度相等(合理均可).
点评 本题考查固体物质溶解度曲线的意义及结晶方法,溶解度概念、饱和溶液中溶质质量分数计算等知识,掌握相关知识结合题意即可灵活解答.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
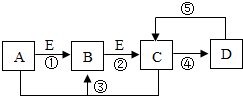 A、B、C、D、E是初中化学中常见的五种物质.在通常情况下,A为黑色粉末状固体,B、C均为无色无味的气体,D为不溶于水的白色固体,在实验室常用含D的物质与稀盐酸反应制取C,单质E是组成空气的主要成分之一.它们之间的关系如图所示(图中反应条件及反应④和⑤中某些反应物、生成物已略去).请回答下列问题:
A、B、C、D、E是初中化学中常见的五种物质.在通常情况下,A为黑色粉末状固体,B、C均为无色无味的气体,D为不溶于水的白色固体,在实验室常用含D的物质与稀盐酸反应制取C,单质E是组成空气的主要成分之一.它们之间的关系如图所示(图中反应条件及反应④和⑤中某些反应物、生成物已略去).请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题


查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 气体 | H2 | CO2 | SO2 |
| 密度g/L | 0.0899 | 1.977 | 2.716 |
| 溶解度/g | 0.0001603 | 0.1688 | 11.28 |
| A. | 排水集气法 | B. | 向下排空气法 | ||
| C. | 向上排空气法 | D. | 向上排空气法或排水集气法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com