
| ||
| ||
| ||
| ||
| △ |


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:初中化学 来源: 题型:阅读理解
 (2013?高淳县二模)学习化学一年后,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:
(2013?高淳县二模)学习化学一年后,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 学习化学一年后,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:
学习化学一年后,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:查看答案和解析>>
科目:初中化学 来源:2013年江苏省南京市高淳县中考化学二模试卷(解析版) 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
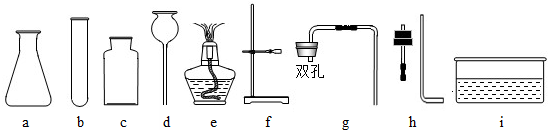
现有下图所示仪器和装置,请回答 下列问题
下列问题
 (1)关闭A装置中的止水夹后,从长颈漏斗向锥形瓶中注入一定量的水,静止后如图所示,则A装置是否漏气?
(1)关闭A装置中的止水夹后,从长颈漏斗向锥形瓶中注入一定量的水,静止后如图所示,则A装置是否漏气?  (填“漏气”、“不漏气”或“无法确定”)
(填“漏气”、“不漏气”或“无法确定”)
(2)实验室若用过氧化氢和二氧化锰制取氧气并用向上排空气法收集气体,应选用的仪
器和装置编号为 ,导管应在集气瓶的 部,是为了___________。该反应的文字表达式为 ,二氧化锰在此反应中是 (填“ 反应物、生成物、催化剂”) 该反应的基本反应类型是 ___________。
(3)实验室用高锰酸钾制取氧气时,其发生装置应选用的仪器和装置的编号是 ,该实验有如下操作步骤:①加热,②检查装置的气密性,③装药品,④用排水法收集气体,⑤从水槽中取出导气管,⑥熄灭酒精灯,⑦连接仪器。其中操作顺序正确的是( )
A.⑦②③①④⑤⑥ B.①⑦③②⑤④⑥ C.⑤⑦③②①④⑥ D.⑦③①②④⑥⑤
该实验中需在试管口放一团棉花,防止_____________________________________
(4)请写出实验室用氯酸钾制取氧气的文字表达式 。
(5)与高锰酸钾制氧气或者用氯酸钾制取氧气相比较,用过氧化氢制取氧气的有点有_____________________________________
(6)实验室用无水醋酸钠(固体)和碱石灰(固体)混合加热制取甲烷。甲烷的密度比空气小,难溶于水。制备并收集甲烷所需仪器和装置的编号为 。
此时试管口应 ,是为了防止___________;
收集甲烷气体的另一种方法是 。
(7)氨气是一种易溶于水的气体,有刺 激性气味,污染空气,若要
激性气味,污染空气,若要 收集氨气这种气体可选用上图中的F装置,烧杯中水的作用是 。
收集氨气这种气体可选用上图中的F装置,烧杯中水的作用是 。
(8) 某同学用E装置集满一瓶氧气后,实验时发现氧气不纯,原因可能是
 ____________________________________
____________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com