
| 44 |
| x |
| 100 |
| 0.5g |
| 12 |
| 12+16×2 |
| 12 |
| 12+16 |
| 0.28g |
| 0.28g+0.22g |


科目:初中化学 来源: 题型:
 (2012?大连)如图所示,某河流上游的造纸厂和小型石灰厂,向 河中非法排放废液和废渣.通过检测发现:造纸厂排放的废液中含有氢氧化钠和碳酸钠;石灰厂排放的废液显碱性,附近的河水浑浊且水温偏高.
(2012?大连)如图所示,某河流上游的造纸厂和小型石灰厂,向 河中非法排放废液和废渣.通过检测发现:造纸厂排放的废液中含有氢氧化钠和碳酸钠;石灰厂排放的废液显碱性,附近的河水浑浊且水温偏高.查看答案和解析>>
科目:初中化学 来源: 题型:
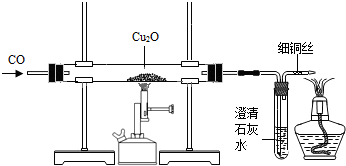
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com