
分析 (1)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式;
(2)根据在化合物中,正负化合价的代数和为零,进行解答.
(3)根据碳酸氢铵的化学性质进行分析解答;
解答 解:(1)由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+X↑,反应前氮、氢、碳、氧原子个数分别为1、5、1、3,反应后的生成物中氮、氢、碳、氧原子个数分别为1、5、0、1,根据反应前后原子种类、数目不变,则每个X分子由1个碳原子和2个氧原子构成,则物质X的化学式为CO2.
(2)根据在化合物中,正负化合价的代数和为零,可得氨(NH3)中氮元素的化合价为:x+(+1)×3=0,x=-3;
(3)碳酸氢铵易分解,化学性质不稳定,故应避光,放在阴冷处保存;
(1)CO2;(2)-3;(3)避光,放在阴冷处.
点评 本题难度不大,利用化学反应前后原子守恒来确定物质的化学式是正确解答此类题的关键.


科目:初中化学 来源: 题型:实验探究题
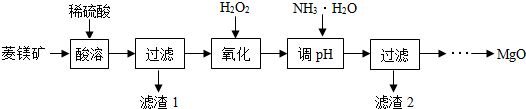
| Mg2+ | Fe2+ | Fe3+ | |
| 开始沉淀 | 9.4 | 7.9 | 2.7 |
| 沉淀完全 | 12.4 | 9.6 | 3.7 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
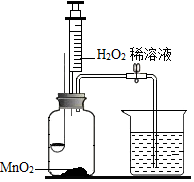 用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.
用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.| 内容 步骤 | 【实验 1】研究燃烧条件 | 【实验 2】研究氧气性质 |
Ⅰ | 烧杯中盛有 80℃的热水,分别在燃烧匙和烧杯中导管口放置一小块白磷,塞紧瓶塞 | 烧杯中盛有 NaOH 溶液,燃烧匙中放入硫磺,点燃硫后迅速将燃烧匙伸入瓶中,塞紧瓶塞 |
| Ⅱ | 推入适量H2O2溶液 | 推入适量H2O2溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 取反应后的滤液观察,滤液不可能呈蓝色 | |
| B. | 取反应后的滤液滴加稀盐酸,有白色沉淀产生 | |
| C. | 取滤渣滴加稀硫酸,一定无气泡产生 | |
| D. | 滤渣中的物质至少有两种 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验序号 | 滴加CuSO4溶液的量 | 实验现象 |
| ① | 第1~6滴 | 有蓝色沉淀,但振荡后沉淀消失,形成亮蓝色溶液 |
| ② | 第7~9滴 | 产生蓝色沉淀,且沉淀逐渐增多,振荡后沉淀不消失,很快沉淀逐渐变黑色 |
| 实验序号 | 实验方法与操作 | 实验现象 | 结论 |
| ③ | 将少许Cu(OH)2粉末加到5mL蒸馏水中,充分振荡 | 沉淀不溶解,液体仍为无色 | 猜想一错误 |
| ④ | 将少许Cu(OH)2粉末加入到足量氢氧化钠浓溶液中,充分振荡 | 固体溶解,溶液呈亮蓝色 | 猜想二正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 小敏发现家中炒过咸菜后未及时清洗的铁锅,比洗净未擦干的铁锅更易生锈.难道是在有盐存在的条件下铁生锈的速度加快了吗?小敏针对问题展开了探究.
小敏发现家中炒过咸菜后未及时清洗的铁锅,比洗净未擦干的铁锅更易生锈.难道是在有盐存在的条件下铁生锈的速度加快了吗?小敏针对问题展开了探究.| 实验步骤 | 可能出现的现象 | 实验结论 |
| 取两支试管分别放入等体积的蒸馏水、加入食盐的蒸馏水,并分别放入洁净无锈的铁钉,浸入一半,静置一段时间 | 放入食盐水的铁钉先生锈,且生锈多 | 盐能加快铁生锈的速度 |
| 编号 | 实验条件 | 放置条件 | 实验现象 |
| 1 | 潮湿的空气 | 密封半浸入蒸馏水中 | 生锈多 |
| 2 | 除去二氧化碳的潮湿空气 | 密封半浸入蒸馏水中 | 生锈少 |
| 3 | 潮湿的空气 | 密封半浸入滴有少量稀盐酸的蒸馏水中 | 生锈最多 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com