
分析 根据硝酸的质量,然后根据反应的化学方程式求出氢氧化钠的质量和生成硝酸钠的质量,再依据溶质质量分数的关系式进行分析解答.
解答 解:100克31.5%的HNO3溶液中HNO3的质量=100g×31,5%=31.5g
设混合物中氢氧化钠的质量是x,生成硝酸钠的质量为y
NaOH+HNO3=H2O+NaNO3
40 63 85
x 31.5 g y
$\frac{40}{x}=\frac{63}{31.5g}$=$\frac{85}{y}$
x=20g
y=42.5g
混合物中氢氧化钠的质量分数=$\frac{20g}{27.5g}$×100%≈72.7%
此时溶液质量硝酸钠的质量=27.5g-20g+42.5g=50g
饱和溶液的质量=27.5g+100g=127.5g
设在10℃时应加溶质质量为z
$\frac{50g}{127.5g-15g}=\frac{50g+z}{127.5g+z}$
z=12g
答案:
(1)混合物中氢氧化钠的质量分数为72.7%;
(2)在10℃时应加12g溶质.
点评 掌握化学方程式的计算格式和规范性,并能根据题目所给信息细心分析解答是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:推断题
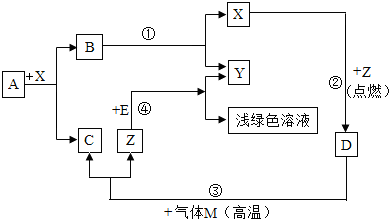
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 氢气具有还原性,在反应中被还原 | |
| B. | 氧化铜具有氧化性,在反应中被还原 | |
| C. | 氢气具有可燃性,是理想的燃料 | |
| D. | 氧化反应不一定是物质与氧气的反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 反应后产生氢气的质量可能相等 | |
| B. | 反应后产生的氢气的质量不相等 | |
| C. | 与金属反应的稀硫酸溶液的质量可能相等 | |
| D. | 与金属反应的稀硫酸溶液质量为:Mg>Fe>Zn |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 过氧化氢分子在化学反应中可以再分 | |
| B. | 化学反应前后分子的总数不变 | |
| C. | 过氧化氢是由水和氧气组成的 | |
| D. | 在化学反应中原子可以再分 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
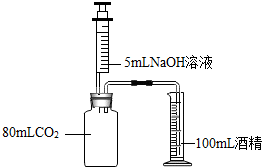 下列三个实验均可证明CO2能与NaOH溶液反应.
下列三个实验均可证明CO2能与NaOH溶液反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com