
某校化学研究小组对某铜器表面的绿色铜锈展开探究,请回答有关问题。
【实验过程】
(1)动手实验
实验一:
| 实验步骤 | 实验现象 | 实验结论 |
| a.取少量铜锈于试管中,加入适量稀硫酸 | 固体溶解,产生气泡,溶液呈蓝色 | 铜锈溶解后形成的溶液中含有的阳离子是 ※ (写化学符号) |
| b.将生成气体通入澄清石灰水 | | 铜锈中含有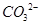 |

【实验过程】
【实验结论】四种元素实验步骤 实验现象 实验结论 Cu2+ 石灰水变浑浊
【猜想】②
【实验设计】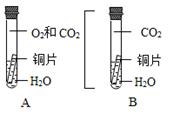
在密封的试管中,铜片的一部分浸入蒸馏水中,另一部分只与二氧化碳充分接触
【预计结论】 ③
解析试题分析:
溶液呈蓝色说明其中含有铜离子,通入气体石灰石变浑浊说明该气体是二氧化碳,【实验结论】综合以上两个实验,可以确认铜锈中含有铜、碳、氢、氧四种元素;猜想②是错误的因其不含有碳元素,实验步骤 实验现象 实验结论 Cu2+ 石灰水变浑浊  两个实验的差别是有无氧气;【预计结论】若A中的铜生锈,B中的铜不生锈,则正确的猜想是③,说明铜生锈需要氧气。
两个实验的差别是有无氧气;【预计结论】若A中的铜生锈,B中的铜不生锈,则正确的猜想是③,说明铜生锈需要氧气。
考点:探究铜锈的组成
点评:题目给的知识点没有学过,较为陌生,但是重点考察的反应的思想,装置等,所以这种题目不要害怕,仔细审题即可。


科目:初中化学 来源: 题型:阅读理解
| 金属 | Cr | Al | Cu |
| 与盐酸反应现 | 气泡产生缓慢,金属逐渐溶解 | 气泡产生激烈,金属迅速溶解 | 无气泡产生,金属无变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 金属 | Cr | Al | Cu |
| 与盐酸反应现 | 气泡产生缓慢,金属逐渐溶解 | 气泡产生激烈,金属迅速溶解 | 无气泡产生,金属无变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 金属 | Cr | Al | Cu |
| 与盐酸反应现象 | 气泡产生缓慢,金 属逐渐溶解 |
气泡产生激烈,金 属迅速溶解 |
无气泡产生,金属 无变化 |
查看答案和解析>>
科目:初中化学 来源:2012-2013学年广西柳州市毕业升学模拟考试化学试卷(解析版) 题型:探究题
某校化学研究小组对某铜器表面的绿色铜锈展开探究,请回答有关问题。
【实验过程】
(1)动手实验
实验一:
|
实验步骤 |
实验现象 |
实验结论 |
|
a.取少量铜锈于试管中,加入适量稀硫酸 |
固体溶解,产生气泡,溶液呈蓝色 |
铜锈溶解后形成的溶液中含有的阳离子是 ※ (写化学符号) |
|
b.将生成气体通入澄清石灰水 |
|
铜锈中含有 |
实验二:另取少量铜锈隔绝空气加热,发现绿色粉末变黑色,试管壁上有水珠。
【实验结论】综合以上两个实验,可以确认铜锈中含有 种元素。
(2)探究铜生锈的条件
【猜想】同学们对空气中有哪些物质参与了铜的生锈作出以下三种猜想:
①CO2、H2O ②O2、H2O ③CO2、H2O、O2
根据铜锈组成元素并结合铁生锈的知识,你认为上述猜想错误的是 (填序号)。
【实验设计】为验证另外两种猜想,同学们设计了下图中A、B两个对比实验,请你在方框内完成实验B的设计(语言叙述或画图说明均可)。
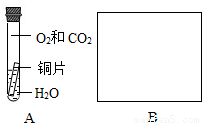
【预计结论】若A中的铜生锈,B中的铜不生锈,则正确的猜想是 (填序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com