
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60[ | 70 | 80 | 100 | |
| 溶解度/g | KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | 246 |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 | 39.8 | |
分析 (1)观察图表,纵向对比对氯化钠和硝酸钾在相同温度下的溶解度,再横向对比氯化钠和硝酸钾在不同温度下的溶解度,然后得出结论.
(2)根据20℃时,氯化钠的溶解度来分析;
(3)溶解度受温度变化影响较大的物质中混入溶解度受温度影响较小的物质,可用降温结晶的方法提纯;
(4)根据两种物质的溶解度及其受温度的影响情况来分析.
解答 解:(1)观察图表可知,0℃时,氯化钠的溶解度是35.7,硝酸钾的溶解度是13.3g,100℃时,氯化钠的溶解度是39.8g,硝酸钾的溶解度是246g,据此可知氯化钠的溶解度受温度变化影响不大;硝酸钾的溶解度受温度变化影响较大.故答案为:氯化钠的溶解度受温度变化影响不大;硝酸钾的溶解度受温度变化影响较大;(合理即可)
(2)由表格信息可知,20℃时,氯化钠的溶解度为36.0g,即在该温度下,100g水中最多溶解36.0g氯化钠就达到饱和状态,若在该温度下的50g水中,最多能溶解18.0g氯化钠就达到饱和状态;该温度下的氯化钠饱和溶液中溶质的质量分数为:$\frac{36g}{36g+100g}×100%$≈26.5%,得不到36%的氯化钠溶液;故填:饱和;不能;
(3)KNO3的溶解度受度变化影响较大,NaCl的溶解度受温度影响较小,所以若KNO3中混有少量NaCl,可利用降温结晶的方法提纯KNO3;故填:降温结晶法;
(4)A.两种物质的溶解度都是最温度的降低而减小,所以80℃时的饱和溶液,降温至20℃时,仍为饱和状态,故正确;
B.由表格信息可知,20℃时,KNO3的溶解度小于NaCl的溶解度,故该温度的饱和溶液中,氯化钠饱和溶液的浓度大,故正确;
C.此过程中,溶剂的量不变,因为80℃时,硝酸钾的溶解度远大于氯化钠的溶解度,所以该温度下等质量的硝酸钾和氯化钠配制成饱和溶液,氯化钠需要的溶剂多,故错误.故填:A、B.
点评 本题考查了据溶解度的意义和饱和溶液中溶质的质量分数分析解答问题,难度不大.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 主食 | 米饭 |
| 副食 | 红烧肉、糖醋鱼、排骨汤 |
| 饮料 | 加钙牛奶 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
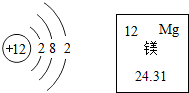 如图是镁元素在元素周期表中的信息和该原子的原子结构示意图,据此判断,下列说法不正确的是( )
如图是镁元素在元素周期表中的信息和该原子的原子结构示意图,据此判断,下列说法不正确的是( )| A. | 镁原子的质子数为12 | |
| B. | 镁原子的相对原子质量为24.31g | |
| C. | 镁位于周期表中第3周期,第2主族 | |
| D. | 在化学反应中,镁原子容易失去2个电子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验方法 | 可能观察到的现象 | 结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 样品中一定含有Na2CO3 | B. | 样品中一定含有KNO3 | ||
| C. | 样品中一定含有Ba(NO3)2 | D. | 样品中一定含有Na2CO3和KNO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 浓度级别 | 标准(mgm3) |
| 一级 | 浓度≤0.15 |
| 二级 | 0.15<浓度≤0.50 |
| 三级 | 0.50≤浓度≤0.70 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com