
 考前必练系列答案
考前必练系列答案科目:初中化学 来源: 题型:
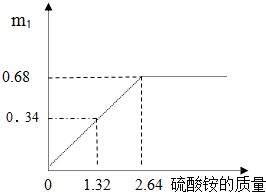 某化工集团生产的化肥硫酸铵[(NH4)2SO4],含有硫酸钾.其产品包装上标明:硫酸铵[(NH4)2SO4]≥70%.为测定该化肥产品中硫酸铵的质量分数,进行如下实验:取一定量的该化肥配成200g溶液,平均分成两份,(假设所有的反应都是完全反应)
某化工集团生产的化肥硫酸铵[(NH4)2SO4],含有硫酸钾.其产品包装上标明:硫酸铵[(NH4)2SO4]≥70%.为测定该化肥产品中硫酸铵的质量分数,进行如下实验:取一定量的该化肥配成200g溶液,平均分成两份,(假设所有的反应都是完全反应)| 加入硝酸钡溶液质量/g | 10 | 20 | 45 | 55 |
| 产生白色沉淀质量/g | 2、33 | 4、66 | 6、99 | 6、99 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 水的质量(g) | 10 | 50 | 100 |
| KNO3的质量(g) | 3.2 | 15.8 | 31.6 |
| 温度(℃) | 20 | 40 | 60 |
| KNO3的质量(g) | 6.3 | 12.8 | 22.0 |
| 实验操作 | 实验现象和溶解程度 | 实验结果 |
| 取100mL水,加入25g硝酸钾,搅拌,恢复至20℃ | 全部溶解 | 得溶液① |
| 再加w g硝酸钾,搅拌,恢复至20℃ | 恰好饱和 | 得溶液② |
| 再加25g硝酸钾,搅拌,恢复至20℃ | 不溶解 | 得溶液③ |
| 加热 | 全部溶解 | 得溶液④ |
| 冷却至20℃ | 析出晶体a | 得溶液⑤ |
| 蒸发掉10g水,恢复至20℃ | 析出晶体b | 得溶液⑥ |
查看答案和解析>>
科目:初中化学 来源: 题型:



查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某化工集团生产的化肥硫酸铵[(NH4)2SO4],含有硫酸钾.其产品包装上标明:硫酸铵[(NH4)2SO4]≥70%.为测定该化肥产品中硫酸铵的质量分数,进行如下实验:取一定量的该化肥配成200g溶液,平均分成两份,(假设所有的反应都是完全反应)
某化工集团生产的化肥硫酸铵[(NH4)2SO4],含有硫酸钾.其产品包装上标明:硫酸铵[(NH4)2SO4]≥70%.为测定该化肥产品中硫酸铵的质量分数,进行如下实验:取一定量的该化肥配成200g溶液,平均分成两份,(假设所有的反应都是完全反应)| 加入硝酸钡溶液质量/g | 10 | 20 | 45 | 55 |
| 产生白色沉淀质量/g | 2、33 | 4、66 | 6、99 | 6、99 |
查看答案和解析>>
科目:初中化学 来源:2011年广东省佛山市碧江中学中考化学模拟试卷(八)(解析版) 题型:解答题
| 加入硝酸钡溶液质量/g | 10 | 20 | 45 | 55 |
| 产生白色沉淀质量/g | 2、33 | 4、66 | 6、99 | 6、99 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com