
| A | B | C | D | |
| 先加x | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无现象 |
| 再加稀硝酸 | 沉淀不消失 | 沉淀消失有气体产生 | 沉淀不消失 | 无现象 |


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:初中化学 来源: 题型:
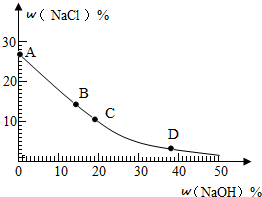
查看答案和解析>>
科目:初中化学 来源: 题型:
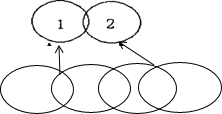
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:
 如图所示,在河边有A、B、C、D四个化学试剂厂向河中排放废水,每个工厂的废水里各含有NaOH、HCl、MgCl2、Na2CO3等四种物质中的一种.某中学的环保小组对该河流的污染状况检测时发现:A处河水使紫色石蕊试液变蓝色;B处河水出现白色浑浊;D处河水有大量气泡产生;E处河水澄清,能使紫色石蕊试液变蓝色;F处河水经测定和PH等于7.
如图所示,在河边有A、B、C、D四个化学试剂厂向河中排放废水,每个工厂的废水里各含有NaOH、HCl、MgCl2、Na2CO3等四种物质中的一种.某中学的环保小组对该河流的污染状况检测时发现:A处河水使紫色石蕊试液变蓝色;B处河水出现白色浑浊;D处河水有大量气泡产生;E处河水澄清,能使紫色石蕊试液变蓝色;F处河水经测定和PH等于7.查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com