
(3分)实验室有一瓶硫酸废液,老师请小红同学设计方案测定该废液中硫酸的质量分数。小红同学先取一洁净小烧杯,称其质量为18.2g,然后往其中倒入适量的硫酸废液后称量,总质量为33.2g,之后,将一枚质量为10.8g的铁钉(已用砂纸打磨去掉铁锈)放入该小烧杯中反应,当反应后的溶液呈中性时再次称量,总质量为43.9 g。请回答下列问题:
反应中产生的气体的质量是。
计算该废液中硫酸的质量分数(写出计算过程,计算结果保留一位小数)。
如果铁钉的铁锈未除净,对计算结果的影响是 (选填“偏大”、“偏小”、“无影响”) 。
(1)0.1g(2)32.7%(3)偏小
解析试题分析:(1)可根据质量守恒定律计算出生成气体的质量。33.2g+10.8 g -43.9 g =0.1g
(2)已知量:氢气的质量0.1g 未知量:硫酸的质量分数。
解题思路:可通过化学方程式中氢气与纯硫酸的质量关系求解出纯硫酸的质量。进一步求出硫酸的质量分数。具体过程如下:解:设参加反应硫酸的质量为x
Fe+H2SO4="=" FeSO4+ H2↑
98 2
X 0.1g
98 :X = 2:0.1g
X =4.9g
硫酸的质量分数为(4.9/33.2-18.2)×100%=32.7%……… (1分)
(3)如果铁钉的铁锈未除净,则其中一部分硫酸会与铁锈反应。这部分硫酸不在计算的范围内。所以会使计算结果偏小。
考点:综合计算


科目:初中化学 来源: 题型:计算题
(6 分)镁是一种用途广泛的金属材料,目前大部分镁都是利用从海水中提取的镁盐 制取的。某校化学活动小组欲测定海水中氯化镁的含量,取海水样品 200g,加入适量 氢氧化钠溶液,至恰好完全反应为止,称量所得沉淀物的质量为 0.58g。 请你根据上述资料,回答下列问题:
⑴金属镁的物理性质有: 。(答出一条即可)
⑵查阅资料可知,海水中镁元素的含量比较低,所以,从海水中提取 MgCl2 时, 经历了“MgCl2 → Mg(OH)2 → MgCl2”的转化过程,请分析这样做的目的是
⑶列式计算:上述 200g 海水样品中,所含 MgCl2 的质量是多少?
(提示:MgCl2 + 2NaOH = Mg(OH)2↓ + 2NaCl )
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
化学兴趣小组的同学为了测定某赤铁矿石中氧化铁的质量分数。
Ⅰ.甲同学取一定质量的赤铁矿粉与过量的木炭粉混合后,用下图所示装置以合理的操作步骤测定(假设杂质始终不发生变化);反应生成单质铁和二氧化碳,以及少量的一氧化碳。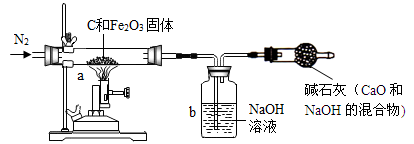
(1) 实验中持续通入干燥的氮气。加热前缓缓通入一段时间,其作用是 。
(2)反应结束后,甲同学熄灭了喷灯的火焰后,马上停止通入N2,他这样操作引起的后果
是 。
(3)如果b装置中氢氧化钠溶液对二氧化碳的吸收是完全的,那么甲同学用b装置中氢氧
化钠溶液的质量变化测定出氧化铁的质量分数将 (选填“偏大”、“偏小”
或“准确”)。
Ⅱ.乙同学取氧化铁的质量分数为80%的赤铁矿粉10g,加入足量稀盐酸,恰好完全反应,
共用去稀盐酸154.5g(假设杂质既不溶于水也不与酸发生反应)。
试计算反应后溶液中溶质的质量分数。(请写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(7分)为测定某纯碱样品(含氢氧化钠杂质)中碳酸钠的含量,进行如下实验:取65g纯碱样品平均分为5份,分别加入相同质量分数的稀盐酸溶液,获得如下实验数据:
| 实验 | 1 | 2 | 3 | 4 | 5 |
| 样品质量/g | 13 | 13 | 13 | 13 | 13 |
| 加入盐酸质量/g | 15 | 30 | 80 | 130 | 150 |
| 反应后物质质量/g | 28 | 43 | 90.8 | 138.6 | 158.6 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(4分)科学实验提倡绿色环保,对实验装置进行微型化改进是一条很好的途径。图甲是实验室制取并检验CO2的装置,图乙是对图甲实验装置的“微型”化改进后的装置。 
(1)图乙中微型塑料滴管在实验中的作用与图甲中的 仪器相同(填字母编号)。
(2)通常用甲装置完成该实验需要的盐酸是“微型”实验装置用量的10倍,采用“微型”实验装置具有的优点是 。
(3)用乙装置完成“制取并检验CO2”的实验,消耗了0.73g10%的盐酸。请计算实验过程中产生CO2的质量是多少克?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(3分)28.7g的氯化钠和硝酸钠的混合物,溶于100g水中,向所得溶液中加入134g的硝酸银溶液,恰好完全反应,得到溶液的质量是234g。计算:原混合物中钠元素的质量分数。(已知:AgNO3 + NaCl = AgCl↓+ NaNO3;计算结果精确到1%)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(3分)工业上使用“渗铬(Cr)技术”可提高钢铁制品的抗腐蚀能力。其中一个主要反应的化学方程式:Fe + CrCl2 =" Cr" + FeCl2。已知参加反应铁的质量为112 kg,计算生成铬的质量。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
将117.0g氯化钠溶液与140.0g的硝酸银溶液混合,恰好完全反应,过滤后所得溶液的质量为228.3g。计算该氯化钠溶液的溶质质量分数?
(反应的化学方程式为NaCl+AgNO3=AgCl↓+NaNO3)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
张南同学为测定某赤铁矿样品中氧化铁的含量,取10g此样品,分五次向其中加入稀硫酸使之充分反应(假设样品中杂质不与稀硫酸反应,也不溶于水)。每次加入的稀硫酸质量及测定剩余固体的质量,记录数据如下表:
| | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 加入稀硫酸的质量/g | l0 | l0 | l0 | l0 | l0 |
| 剩余固体质量/g | 8.4 | 6.8 | 5.2 | 3.6 | 3.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com