
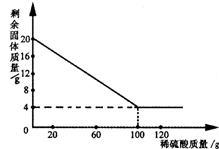
 取20.0g铜和氧化铜的混合物样品,对其进行成分分析,向盛有该样品的烧杯中加入足量一定溶质质量分数的稀硫酸充分反应.所用稀硫 酸的质量与烧杯中剩余固体的质量变化关系如图所示,请回答:
取20.0g铜和氧化铜的混合物样品,对其进行成分分析,向盛有该样品的烧杯中加入足量一定溶质质量分数的稀硫酸充分反应.所用稀硫 酸的质量与烧杯中剩余固体的质量变化关系如图所示,请回答: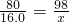 x=19.6g
x=19.6g 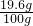 ×l00%=19.6%
×l00%=19.6% 

科目:初中化学 来源: 题型:
| 加硫酸的序号 | 加入硫酸的体积/mL | 剩余固体的质量/g |
| 1 | 20.0 | 16.0 |
| 2 | 20.0 | 12.0 |
| 3 | 20.0 | 8.0 |
| 4 | 20.0 | 8.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 加硫酸的序号 | 加入硫酸的体积/mL | 剩余固体的质量/g |
| 1 | 20.0 | 16.0 |
| 2 | 20.0 | 12.0 |
| 3 | 20.0 | 8.0 |
| 4 | 20.0 | 8.0 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
| 加硫酸的序号 | 加入硫酸的体积/mL | 剩余固体的质量/g |
| 1 | 20.0 | 16.0 |
| 2 | 20.0 | 12.0 |
| 3 | 20.0 | 8.0 |
| 4 | 20.0 | 8.0 |
查看答案和解析>>
科目:初中化学 来源:2008年第十八届“天原杯”全国初中学生化学素质和实验能力竞赛(山东赛区)初赛试卷(解析版) 题型:解答题
| 加硫酸的序号 | 加入硫酸的体积/mL | 剩余固体的质量/g |
| 1 | 20.0 | 16.0 |
| 2 | 20.0 | 12.0 |
| 3 | 20.0 | 8.0 |
| 4 | 20.0 | 8.0 |
查看答案和解析>>
科目:初中化学 来源:2003年第十三届“天原杯”全国初中学生化学素质和实验能力竞赛复赛试卷(解析版) 题型:解答题
| 加硫酸的序号 | 加入硫酸的体积/mL | 剩余固体的质量/g |
| 1 | 20.0 | 16.0 |
| 2 | 20.0 | 12.0 |
| 3 | 20.0 | 8.0 |
| 4 | 20.0 | 8.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com