某铜铁合金6.4g,跟100g稀硫酸恰好完全反应,生成0.2g氢气,计算:
(1)该合金中铁的质量分数;
(2)该稀硫酸中溶质的质量分数.
【答案】
分析:(1)由生成氢气的质量结合合金中铁与硫酸反应的化学方程式来计算出铁的质量,进而计算出合金中铁的质量分数;
(2)由生成氢气的质量结合合金中铁与硫酸反应的化学方程式来计算出反应的硫酸的质量,进而计算出稀硫酸的质量分数.
解答:解:设合金中铁的质量为x,稀硫酸中硫酸的质量为y,则:
Fe+H
2SO
4═FeSO
4+H
2↑
56 98 2
x y 0.2g
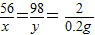
解得:x=5.6g,y=9.8g;
(1)合金中铁的质量分数为:
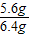
×100%=80%;
(2)该稀硫酸中溶质的质量分数为:
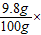
100%=9.8%;
答:(1)该合金中铁的质量分数为80%;
(2)该稀硫酸中溶质的质量分数9.8%.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

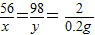
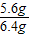 ×100%=80%;
×100%=80%;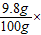 100%=9.8%;
100%=9.8%;

 阅读快车系列答案
阅读快车系列答案