
���dz�˵�ġ������ָ��������ͭ����������������ѧ֪ʶ�ش�
��1��������»�����˵����ʹ�ڸ�����Ҳ����________��Ӧ��
��2����ͭƬ��ͭп�Ͻ𣩺�ͭƬ��̻�����ͭƬ�����¿̺ۣ�˵����ͭƬ��Ӳ�ȱ�ͭƬ��Ӳ��______����� ��С������
��3������������������ʢ��ũҩ������Һ����Ҫ�ɷ�������ͭ���������ƣ����û�ѧ����ʽ��ʾ��ԭ��____________________��
��4����ֹ������ʴ�DZ���������Դ����Ч;��֮һ��д��һ�ַ�ֹ����Ʒ����ľ��巽����______ ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2017����б�ҵ��ѧ���ԣ����ջ���������ѧ�������棩 ���ͣ�ѡ�������
�����ĸ�ͼ���У�����ȷ��ӳ��Ӧ�仯��ϵ����
|
|
|
|
A����CuFe2O4-x����������ֽ�ˮ������������ | B�����Ȼ��Ƶı�����Һ�м�������� | C��������������������ͭ��Һ�м�������������Һ | D����һ��������̼������Һ�м�ˮ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017����б�ҵ��ѧ���ԣ�������̶������ѧ�������棩 ���ͣ������
��������;�ܹ㣬����Ӧ�ñ����ý�����Դ���ش��������⣺
��1�����������������ߣ�����Ϊ�������� ��������ԡ������ԡ�����
��2����ͭƬ��ͭƬ��Ƚϣ�Ӳ�Ƚϴ���� ��
��3��д��һ����ֹ������Ľ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017����б�ҵ��ѧ���ԣ�������̶������ѧ�������棩 ���ͣ�ѡ����
���ж�ʵ�������������������ǣ� ��
A��þ���ڿ����о���ȼ�գ�����ҫ�۰⣬����һ�ְ�ɫ����
B������������ȼ�ղ�������������ɫ���棬������ɫ�д̼�����ζ������
C����˿�������о���ȼ�գ��������䣬����һ�ֺ�ɫ����
D��������������ط���ˮ�У�������Һ���Ϻ�ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017����б�ҵ��ѧ���ԣ���������������ѧ�������棩 ���ͣ������
��������װ��ͼ���ش����⣺
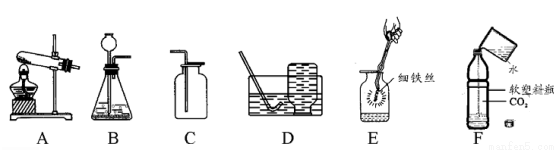
��1���ø��������ȡ������ѡ�õķ���װ����_______������ţ���Ϊ��ֹ������ط�ĩ���뵼�ܣ���װ������һ��Ľ�����________������Dװ���ռ����������۲쵽______ʱ����ɿ�ʼ�ռ���
��2��ʵ������ȡ������̼Ӧѡ�õ�һ��װ����_______������ţ�����Ӧ�Ļ�ѧ����ʽ��_____��ͼG��ijͬѧ���ñ����Թ���Ƶ��ƶ�����̼�ķ���װ�ã�����Ƴ��˷������õ��ŵ��⣬����дһ���ŵ㣺________ ��
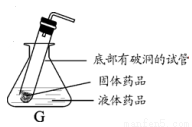
��3�����ռ����������ͼE��˿ȼ�յ�ʵ�飬����ƿ��Ԥ�ȷ�����ˮ��ԭ����_______ ����ͼF��װ��CO2 ��������ƿע��Լ1/3�����ˮ����������ƿ�ǣ����۲쵽��������_________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017����б�ҵ��ѧ���ԣ���������������ѧ�������棩 ���ͣ�ѡ����
����ͼ�����Ӧ��������ϵ���
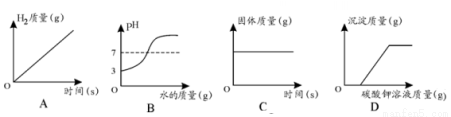
A����һ������п���м���ϡ���� B���� pH=3 ����Һ�м�ˮ
C����һ�����Ķ��������м������������Һ D����һ�������Ȼ�����Һ�м���̼�����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017����б�ҵ��ѧ���ԣ���������������ѧ�������棩 ���ͣ�ѡ����
�������ʵķ�����ȷ����
A����ռ���� B��������ɱ���������
C��������������ˮ����� D���л���ƾ���̼������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017����б�ҵ��ѧ���ԣ�����¦������ѧ�������棩 ���ͣ�������
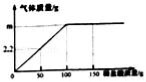
С�մ��Ƿ��ͷ۵���Ҫ�ɷ�֮һ����������������ʳƷ��һ��ѧ��ȤС���ijС�մ���Ʒ�и��ɷֵĺ����������²ⶨ����һ�������ĸ���Ʒ����֪����ֻ��NaCl����ˮȫ���ܽ�õ�104.4g��Һ�������Һ������ϡ���ᣬ���������������ϡ�����������ϵ��ͼ��ʾ���Լ��㣺
��1��m��ֵΪ ��
��2����ǡ����ȫ��Ӧʱ��������Һ��������������Ϊ3%����ԭС�մ���Ʒ��NaHCO3��NaCl�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017����б�ҵ��ѧ���ԣ�����̩�ݾ�����ѧ�������棩 ���ͣ�̽����
ij��ѧ��ȤС��ͨ��̽���ѧϰ�����⻯ѧ֪ʶ������һ���о�ѧϰ�����ش��й����⣮
�о����⣺ˮ��Һ�и��ֽⷴӦ��ʵ��
�����Ϣ��һ���������Һ�У����ӵ���ĿԽ�࣬�����ӵ�Ũ��Խ�絼�ʴ��������ڲ�����Һ�ĵ�����ǿ�����ܷ�ӳ����Ũ�ȴ�С����ͬ�¶���ͬ����Һ�絼��Խ������Ũ��Խ��
��1��ʵ��һ�����������£���һ�����һ��Ũ�ȵ�ϡBa��OH��2��Һ�еμ�2��3����ɫ��̪��Һ������絼�ʴ�������Ȼ��μ�ϡ���ᣬ�����Һ�ĵ絼�ʱ仯��ͼ�м�������ʾ��
��д��Ba��OH��2��H2SO4��Ӧ�Ļ�ѧ����ʽ ��
�ڼ�����M��ʱ���Һ��� ɫ��
��ͨ���Լ����ߵķ���������˵��������� ������ţ���
A��M��ǰ�����»��Ĺ����У�H+��OH����ϳ�H2O��Ba2+��SO42����ϳ�BaSO4
B��M��ʱ����Ũ�ȼ���Ϊ�� C��M�����Һ�絼��������������Һ��H+��������
��2��ʵ��������������£������ͬŨ�ȵ�ϡBa��OH��2��Һ�еμ�2��3����ɫ��̪��Һ������絼�ʴ�������Ȼ��μ�ϡNa2SO4��Һ�������Һ�ĵ絼�ʱ仯����ͼ��������ʾ��
��ͨ���������ߵķ���������˵��������� ������ţ���
A����ʼ����ȫ��Ӧ�����У��絼�ʼ�С����Һ�ɺ�ɫ��Ϊ��ɫ
B���絼���½�����͵�ʱ��Ȼ�ϴ�����Һ�л����ڽ϶�����
C������ʵ������У���Һ��Na+��Ŀһֱ����
��N��ʱ����Һ�к��е������� �������ӷ��ţ���
��ͨ���ȽϷ����������ѧ֪ʶ��֪����Һ�и��ֽⷴӦ��ʵ���Dz��뷴Ӧ�����ӣ���������˳����������ˮ��������Ũ�� �������С������
��3����չ���������ʾ����д���ӷ���ʽ��
ʾ��AgNO3+NaCl=AgCl��+NaNO3���ӷ���ʽ��Ag++Cl��=AgCl��
��д��BaCl2+Na2SO4=BaSO4��+2NaCl���ӷ���ʽ�� ��
����һ�������ͳ���ʯ��ˮ�г���ͨ�������CO2���壬��Һ�ȱ���Ǻ��������ʧ�����Ʋ�˹��̵���Һ��Ca2+��Ũ�ȱ仯��� ��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com