解:(1)铁元素的相对原子质量为56,FeSO
4的相对分子质量=56+32+16×4=152
∴Fe元素的质量分数=
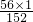
=36.8%;故填:36.8%.
FeSO
4的质量=
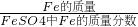
=
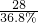
=76,故填:76
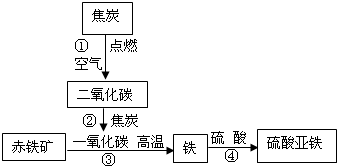
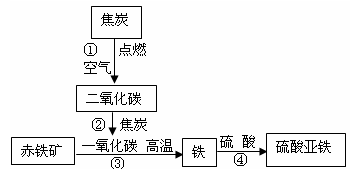
(2)①C+O
2
CO
2③Fe
2O
3+3CO

2Fe+3CO
2④Fe+H
2SO
4=FeSO
4+H
2↑
(3)设需要xKg硫酸溶液,反应的化学方程式为:
Fe+H
2SO
4 =FeSO
4 +H
2↑
98 152
10%?x 15.2
∴
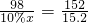
解之得:x=98
故填:98
分析:(1)物质中某元素的质量分数就是该元素的质量与组成该物质的元素质量之比,计算公式为:
A元素的质量分数=
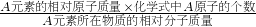
×100%
(2)该框图的起始物质都已知,可根据化学方程式的书写要求逐一写出各反应的方程式.
(3)可先写化学方程式、设未知数、找质量比、列比例式求解,也可根据质量守恒定律求解.
点评:1、本题主要是考查学生根据化学式求元素质量分数及根据化学方程式找出已知量和未知量的关系列比例式求解问题的能力.根据化学方程式的计算,就是依据反应物和生成物的质量比进行的;由已知物的质量可以求出生成物的质量,反之,已知生成物的质量也可算出所需反应物的质量.
2、对于第三问,可用另外一种方法求解
根据质量守恒定律知硫酸溶液和硫酸亚铁溶液中硫酸根离子质量相等的原则,设需要xKg硫酸,则有比例式:
FeSO
4的质量×FeSO
4中的SO
4 2-的质量分数=H
2SO
4的质量×H
2SO
4中SO
42-的质量分数
即:15.2×

=10%?x?

解之得:x=98


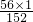 =36.8%;故填:36.8%.
=36.8%;故填:36.8%.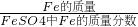 =
=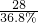 =76,故填:76
=76,故填:76 CO2
CO2 2Fe+3CO2
2Fe+3CO2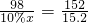
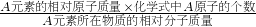 ×100%
×100% =10%?x?
=10%?x?


 名校课堂系列答案
名校课堂系列答案