
 某人设计了右图所示的实验.实验操作及现象如下:
某人设计了右图所示的实验.实验操作及现象如下: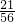 :
: =3:4,故固体产物的化学式为Fe3O4;
=3:4,故固体产物的化学式为Fe3O4; Fe3O4+4H2;
Fe3O4+4H2; Fe3O4+4H2
Fe3O4+4H2

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:初中化学 来源: 题型:
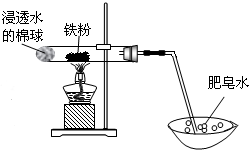 某人设计了右图所示的实验.实验操作及现象如下:
某人设计了右图所示的实验.实验操作及现象如下:查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:初中化学 来源:2004年第十四届“天原杯”全国初中学生化学素质和实验能力竞赛(重庆赛区)初赛试卷(解析版) 题型:解答题

查看答案和解析>>
科目:初中化学 来源:2008年湖南省益阳市南县九年级化学知识竞赛复赛试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com