实验室用高锰酸钾制取氧气.
(1)求反应中各物质间的质量比:________.
(2)若要制得8g氧气,最少需要高锰酸钾的质量为________g.
(3)反应完全后,混合物中氧化物的质量分数为________.
解:设若要制得8g氧气,最少需要高锰酸钾的质量为x,反应完全后,混合物中二氧化锰的质量为y,
2KMnO
4
K
2MnO
4+MnO
2+O
2↑
316 197 87 32
x y 8g
(1)反应中各物质间的质量比为:316:197:87:32;
(2)316:32=x:8g,
解之得:x=79g;
(3)87:32=y:8g,
解之得:y=21.75g,
反应完全后,混合物中氧化物的质量分数为:
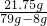
×100%≈30.6%.
故答案为:(1)316:197:87:32;(2)79g;(3)30.6%.
分析:(1)根据加热高锰酸钾的化学方程式,得出各物质的相对分子质量,即可计算出反应中各物质间的质量比;
(2)根据加热高锰酸钾的化学方程式和生成的氧气的质量,列出比例式,即可计算出需要高锰酸钾的质量;
(3)根据加热高锰酸钾的化学方程式和生成的氧气的质量,列出比例式,即可计算混合物中二氧化锰的质量,然后根据质量分数公式计算即可.(反应完全后混合物的质量=高锰酸钾的质量-生成氧气的质量)
点评:本题主要考查学生利用化学方程式和质量分数公式进行计算的能力.考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑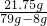 ×100%≈30.6%.
×100%≈30.6%.