
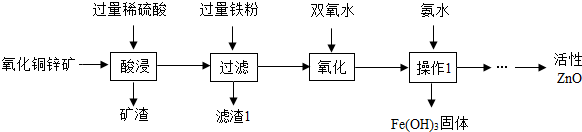
分析 (1)根据实验操作的名称分析;
(2)根据反应物、生成物及质量守恒定律分析解答;
(3)根据基本反应类型的不同特征分析,根据溶液中的固体成份分析;
(4)根据除杂实验的注意事项分析;
解答 解:(1)操作1是将液体和固体分离的操作,是过滤,故填:过滤;
(2)氧化铜锌矿的主要成份是氧化铜和氧化锌,金属氧化物与酸反应生成盐和水,其反应的化学方程式为:ZnO+H2S04═ZnS04+H20,CuO+H2SO4=CuSO4+H2O;故填:ZnO+H2S04═ZnS04+H20,CuO+H2SO4=CuSO4+H2O;
(3)加过量铁粉后,发生的反应是铁和硫酸铜的反应,生成铜和硫酸亚铁,符合置换反应的特征,由于铁粉过量,所以滤渣1的成份是铁和铜,故填:置换反应;Fe、Cu;
(4)除杂实验过程中,要注意不要引入新的杂质,特别是难除去的杂质,双氧水只含有氢和氧两种元素,会与Fe2+反应生成Fe3+和水,而不引入难除掉的其它杂质,故填:不引入较难除去的杂质;
点评 本题看上去是一道分析推断图框题,但题目考查的知识点全是课本基础知识,熟练掌握酸碱盐的化学性质即可解答本题.


科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaOH、Ca(OH)2、HCl、K2CO3 | B. | NaCl、BaCl2、CuSO4、NaOH | ||
| C. | Ba(OH)2、NaCl、Na2SO4、Na2CO3 | D. | AgNO3、HCl、Na2CO3、CaCl2 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 |
| 取少量滤渣于试管中,加入足量 稀盐酸 | 固体部分溶解,有气泡冒出 |

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
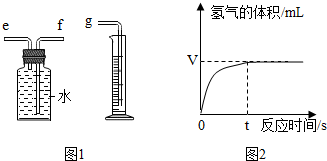 化学兴趣小组对“影响过氧化氢分解反应速率的因素--过氧化氢的质量分数和二氧化锰的用量”进行如下的实验探究,请你参与.
化学兴趣小组对“影响过氧化氢分解反应速率的因素--过氧化氢的质量分数和二氧化锰的用量”进行如下的实验探究,请你参与.| 实验编号 | 过氧化氢的质量分数 (均取10mL) | 二氧化锰粉末 的质量 | 氧气的体积(mL) (均收集5秒钟) |
| a | 5% | 0.2g | 65.8 |
| b | 5% | 0.8g | 85.7 |
| c | 5% | 1.0g | 85.7 |
| d | 10% | 0.2g | 121.9 |
| e | 10% | 0.8g | 171.5 |
| f | 10% | 1.0g | 171.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
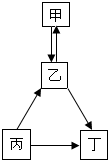 甲、乙、丙、丁均为初中化学常见物质,它们之间的部分转化关系如图所示,关于该转化关系图,下列说法正确的是( )
甲、乙、丙、丁均为初中化学常见物质,它们之间的部分转化关系如图所示,关于该转化关系图,下列说法正确的是( )| A. | 如果丙是碳酸钠,乙是氢氧化钠,则甲是硝酸钠 | |
| B. | 若甲、乙、丁都是氧化物,则丙一定是碳酸钙 | |
| C. | 甲、乙、丙、丁之间的转化可以全部通过复分解反应实现 | |
| D. | 若甲、乙、丙、丁均含有同一种元素,且乙可用来灭火,则丙一定是单质碳 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
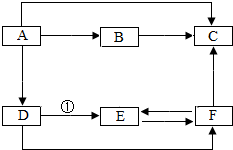 A-F是初中化学常见的化合物,其转化关系如图所示,其中A,B,C都是氧化物,B能使澄清石灰水变浑浊,F是一种不溶于水的蓝色固体,图中“→”表示物质间存在相应的转化关系(部分反应物、生成物和反应条件未标出).请回答:
A-F是初中化学常见的化合物,其转化关系如图所示,其中A,B,C都是氧化物,B能使澄清石灰水变浑浊,F是一种不溶于水的蓝色固体,图中“→”表示物质间存在相应的转化关系(部分反应物、生成物和反应条件未标出).请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com