
(7分))课外活动时,同学们采用以下两种方法测定某氯化钠溶液的溶质质量分数。
(1)【化学方法】向一定量氯化钠溶液中加入足量硝酸银溶液,得到2.87g氯化银固体,则该氯化钠溶液中氯化钠的质量为多少?(根据化学方程式列式计算)
经多次实验测定,该溶液的溶质质量分数为10%。
(2)【物理方法】取一定量该溶液进行蒸发,测量实验数据如下:
| 蒸发皿的质量(g) | 25.0 |
| 蒸发皿+食盐溶液(g) | 45.0 |
| 蒸发皿+食盐晶体(g) | 27.4 |
| 数据处理 | 溶液的溶质质量分数为 |
(1) 1.17g (2) 12% (3) C
解析试题分析:(1)向一定量氯化钠溶液中加入足量硝酸银溶液,发生反应:NaCl+AgNO3==AgCl↓+NaNO3
,根据方程式中NaCl与AgCl的质量关系,即可算出氯化钠的质量
解:设生成氯化钠质量为x
NaCl+AgNO3=AgCl↓ +NaNO3
58.5 143.5
x 2.8 7g 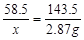
x="1.17g"
(2)根据蒸发皿的质量与蒸发皿+食盐溶液的质量差,可得出食盐溶液的质量=45g-25g=20g,根据蒸发皿的质量与蒸发皿+食盐晶体的质量差,可得出食盐的质量=27.4g-25g=2.4g,所以溶液的溶质质量分数=2.4g/20g×100%=12%
(3)很明显通过物理方法得到的食盐的质量2.4g大于化学方法测定结果1.17g,所以物理方法测定结果产生误差的原因是:A、蒸发时未用玻璃棒搅拌,液体飞溅,所得食盐的质量应减少,错误,B.所取氯化钠溶液质量较大,只影响蒸发的时间,错误,C、蒸发时出现少量晶体时就停止加热,这样得到的晶体中就含有水分,使质量偏大,D、实验后未将玻璃棒上的白色固体移入蒸发皿,只会使得到的晶体质量减少
考点:根据方程式计算,蒸发结晶


科目:初中化学 来源: 题型:填空题
金属是一种非常重要的资源,在生产、生活中有着广泛的用途.
(1)人类每年从自然界提取大量的金属,其中提取量最大的是铁.用赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的化学方程式为 .
(2)每年世界上钢铁的产量很高,可全世界每年因生锈损失的钢铁约占世界钢铁年产量的1/4,这给人类带来了巨大的损失.铁在空气中锈蚀,实际上是铁跟空气中的 共同作用的结果.现有一批铁质螺丝钉已经开始生锈,你能用化学方法除锈,并做防锈处理吗?请简要写出你的做法及涉及到的化学方程式. 。
(3)亮亮同学用稀盐酸和另一种溶液,验证了Mg、Fe、Cu、Ag四种金属的活动性顺序是依次减弱的.请回答下列问题:
①亮亮所用的另一种溶液是 .
②说明Mg比Fe活泼的实验现象是 .
③说明Cu比Ag活泼的实验现象是 .
(4)我国在金属冶炼方面有着悠久的历史,早在南北朝时期就开始冶铸黄铜.黄铜是由铜和锌组成的,它可以用来制造机器、电器零件及日用品.现为测定某黄铜样品中铜的含量,取该黄铜样品10g,放入100g的稀盐酸中,恰好完全反应.此时烧杯内各物质的总质量为109.8g.试计算:
(1)该黄铜样品中铜的质量分数;
(2)反应所用稀盐酸的溶质质量分数.
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
有NaCl 和Na2CO3的混合物样品4g,为了测定该混合物中Na2CO3的质量分数,现将足量盐酸加到此混合物中,得到部分数据与图像。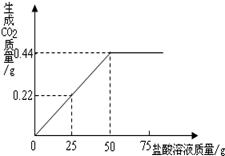
① 样品完全反应后,共放出二氧化碳气体的物质
的量为 mol。
② 计算混合物中Na2CO3的质量分数。
(根据化学方程式列式计算)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
甲乙丙三个实验小组分别进行“Na2CO3和NaOH混合物中Na2CO3含量测定”的实验:
(1)甲组的实验方案是:将50克的混合物溶解在水中配成溶液,滴加10%稀盐酸,观察到现象: 。根据消耗盐酸溶液的质量来测定碳酸钠的含量。你认为这个方案是否正确,理由是_______ 。
(2)乙组同学的方案是:根据沉淀的质量计算得出碳酸钠的含量,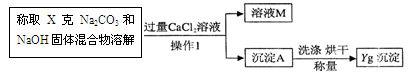
乙经正确计算,得出碳酸钠的含量偏大,原因可能是 ,溶液M中的溶质(用化学式表示)是 。
(3)丙组的实验方案是:将50克样品与足量的稀盐酸反应,用下图装置测定产生的CO2气体的体积,通过计算得出样品中Na2CO3的质量。请分析装置中油层的作用是____ _ ____。现收集到0.1摩尔CO2气体,求原混合物中Na2CO3的质量百分数是多少?(精确到0.1%)。(根据化学方程式,写出计算过程)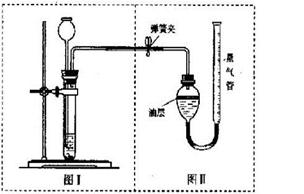
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
为检查某石灰石样品中碳酸钙的纯度,取该样品12g放入烧杯中,再向烧杯中加入35g稀盐酸,恰好完全反应(杂质不参加反应),反应后烧杯中剩余固体物质共42.6 g,
(1)反应生成CO2的质量为 g;
(2)石灰石样品中碳酸钙的质量分数(结果保留至0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
中和反应是放热反应。取10 ml溶质质量分数为10%的NaOH溶液(密度1.10g/ml)置于烧杯中(并滴入2滴酚酞),向烧杯中逐滴加入稀盐酸。随着盐酸的滴入,烧杯中溶液颜色从红色逐渐变浅,当加入10 ml稀盐酸时,溶液恰好变为无色。烧杯中溶液温度与加入盐酸体积之间关系如图所示。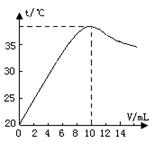
(1)当加入4ml稀盐酸时,烧杯中溶液的溶质为
(写化学式)
(2)试解释烧杯中溶液温度随加入盐酸的体积发生变化的
原因 。
(3)当盐酸与氢氧化钠恰好中和时生成氯化钠多少克?
(精确到0.1g)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(9分)医用二水合氯化钙可用于补钙、抗过敏和消炎等,以某碳酸钙样品(其中含少量Al3+、Fe3+等杂质)生产医用二水合氯化钙的工艺流程为: (已知二水合氯化钙在温度超过160°C时分解为氯化钙和水)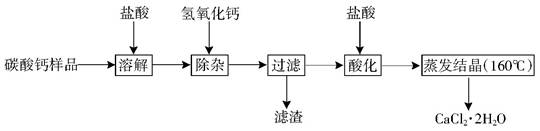
已知:查阅资料得知氢氧化物沉淀及溶解时的pH为:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 2.3 | 4.0 | 开始溶解:7.8 |
| 完全沉淀时的pH | 3.7 | 5.2 | 完全溶解:10.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(3分)取含Na2CO3和NaCl的样品34g放在烧杯中并加入稀盐酸146g,恰好完全反应,此时,烧杯内溶液的总质量为175.6g。
计算:反应后所得溶液的溶质质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com