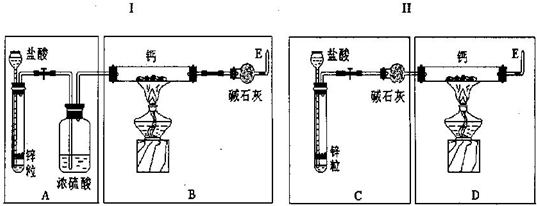
解:(1)钙和氢气在加热的条件下生成氢化钙,方程式是Ca+H
2 
CaH
2;故答案为:Ca+H
2 
CaH
2;
(2)由于锌与盐酸反应制得气体氢气中混有氯化氢和水蒸气,会与锌反应.浓硫酸只除去水蒸气,故应增加除氯化氢装置.故装置Ⅰ的不足之处是制H
2装置后缺少除HCl气体的装置;CaH
2易与水反应,为防空气中水与CaH
2反应,应在制CaH
2装置后加干燥装置. 故装置Ⅱ的不足之处是制CaH
2装置后缺少干燥装置.
故答案为:制H
2装置后缺少除HCl气体的装置;制CaH
2装置后缺少干燥装置;
(3)C中碱石灰会把氢气中的杂质氯化氢和水吸收,B中碱石灰可防止空气中水蒸气与CaH
2反应,故答案为:C、B;
(4)根据题给信息,反应物为CaH
2和水,产物为氢气和氢氧化钙,由此可写出化学方程式为CaH
2+2H
2O=Ca(OH)
2+2H
2↑;
故答案为:CaH
2+2H
2O=Ca(OH)
2+2H
2↑;
(5)氢化钙是固体,携带方便,与水作用,能很快产生氢气,氢气燃烧,放出的热量很多且产物为水对空气不造成污染.故与氢气做能源相比它的优点是携带方便;
故答案为:携带方便.
分析:由于盐酸易挥发,锌与盐酸反应制得气体氢气中混有氯化氢和水蒸气,需先除去.因碱金属或碱土金属(Ⅱ族)与H
2在隔绝空气加热时发生反应,所以需把装置中的空气排净.CaH
2与水反应产生H
2,故需要干燥环境.
点评:进行实验评价时,可从实验目的、装置特点、题给信息及试剂性质综合考虑.

 CaH2;故答案为:Ca+H2
CaH2;故答案为:Ca+H2  CaH2;
CaH2;

 阅读快车系列答案
阅读快车系列答案