
铁是容易生锈的金属,世界上每年因腐蚀而报废的金属设备和材料相当于年产量的20%~40%.
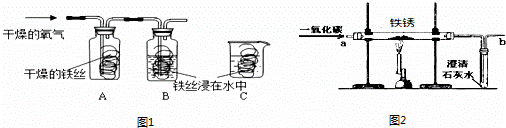
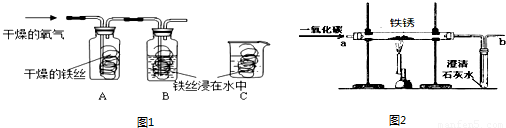
(1)同学们用图1所示装置探究铁生锈的条件,将干燥的氧气通入A、B瓶内,大约经4~5min,A处的铁丝依然光亮,而B处的铁丝表面变暗,C中铁丝依然光亮.A、B进行对比,现象不同,说明铁生锈与 有关.B、C处的现象对比说明,决定铁生锈快慢的一个重要因素是 .
(2)下列方法不能除去铁制品表面铁锈的是
A.用氢氧化钠溶液浸泡 B.用稀盐酸浸泡 C.用砂纸打磨 D.用厕所清洁剂(pH=1)洗
(3)请你列举一种防止铁生锈的措施 .
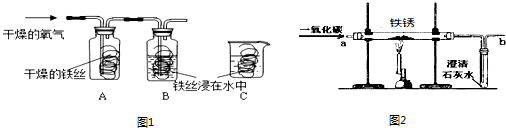
(4)实验室内将铁锈再生为铁,可利用图2所示装置,请回答:
①实验前应该先通入CO,后加热,其目的是 .
②在装置b处再放置一盏燃着的酒精灯,其目的是 .
③铁锈的主要成分氧化铁再生为铁的化学方程式为 .
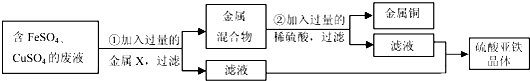
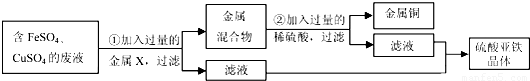
(5)学校实验室从校办厂拉回一桶含有FeSO4、CuSO4的废液,同学们想从中回收金属铜和硫酸亚铁晶体,设计了如下实验方案.结合实验方案回答下列问题:

步骤①中,金属X是 ,步骤②中,加入过量稀硫酸的目的是 ,证明步骤②中硫酸已过量的以下方法合理的是
A.加入硫酸后,立即测出溶液的pH小于7
B.充分反应后,取少量溶液加铁时有气泡产生
C.充分反应后,取少量溶液滴加氯化钡溶液时有沉淀产生.
| (1)根据铁生锈的条件通过实验比较可以判断影响铁生锈的因素和速率; (2)除锈的方法常见的有化学法﹣酸洗法和物理打磨法; (3)根据防锈的措施分析:阻止铁的生锈; (4)根据冶炼铁的注意事项分析结合一氧化碳的可燃性及毒性分析并写出反应的方程式; (5)由于目的是获得铜单质和硫酸亚铁,所以需要将铜离子转化为铜单质,而溶液中需要的是硫酸亚铁而不能引入新的杂质,所以加入的能够将铜离子转化为铜单质的只能是单质铁;由于加入的铁是过量的,加入过量稀硫酸的目的是除去铜中的铁,将金属混合物中的铁全部转化为硫酸亚铁; 要证明硫酸过量,可以从硫酸的性质结合选项分析. | |
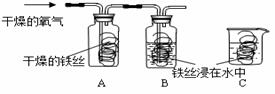
| 解答: | 解:(1)将干燥的氧气通入A、B瓶内,大约经4~5min,A处的铁丝依然光亮,而B处的铁丝表面变暗,是因为A处的铁丝没有与水接触,而B处的铁丝既和氧气接触又和水接触,所以B处生锈,通过A、B对比说明铁生锈与氧气和水有关;B、C处的铁丝都与水和氧气接触,不同的是B处的氧气浓度比C处的氧气浓度大,导致B处的铁生锈快,说明铁生锈快慢与氧气的浓度有关; (2)铁锈的成分是氧化铁能够和酸性物质反应,其中B和C溶液都显酸性,因此可以除锈;A是氢氧化钠显碱性,和氧化铁不反应,因此不能除锈;C用砂纸打磨属于物理除锈法,故可以,故不正确的是A; (3)铁与水和氧气同时接触时容易生锈,当铁与水、氧气隔绝时不容易生锈,所以保持表面干燥、涂油漆可以使铁制品与水和氧气隔绝或加工成耐腐蚀的合金等; (4)①因为一氧化碳具有可燃性,若含有空气点燃时容易发生爆炸,因此实验前应该先通入CO,后加热,其目的是:排尽装置内的空气,防止加热时发生爆炸; ②因为一氧化碳是有毒的气体,因此要把多余的一氧化碳进行尾气处理,因此在装置b处再放置一盏燃着的酒精灯,其目的是:点燃没有反应的CO,防止污染空气; ③氧化铁再生为铁可以通过还原剂如一氧化碳进行还原,反应的方程式为:Fe2O3+3CO (5)由题意可知,由于需要将铜离子转化为铜单质,而溶液还必须为硫酸亚铁,即不能引入新的杂质,所以可以加入铁将铜离子转化为铜单质.该反应的化学方程式为:Fe+CuSO4 ═FeSO4 +Cu;步骤②中,加入过量稀硫酸的目的是除去铜中的铁,; A.若硫酸过量,pH小于7,但加入硫酸后,没等充分反应而是立即测出溶液的pH小于7,不能说明硫酸过量,因此错误; B.充分反应后,则取少量溶液加铁时有气泡产生,说明硫酸过量是正确的; C.充分反应后,取少量溶液滴加氯化钡溶液时有沉淀产生,说明含有硫酸根离子,但硫酸根离子可能来自于硫酸亚铁中的硫酸根离子; 故选择:B; 故答案为:(1)氧气和水; 与氧气的浓度有关; (2)A; (3)保持表面干燥、涂保护膜、制成合金; (4)①排尽装置内的空气,防止加热时发生爆炸; ②点燃没有反应的CO,防止污染空气;③Fe2O3+3CO (5)Fe;将金属混合物中的铁全部转化为硫酸亚铁; B. |


科目:初中化学 来源: 题型:阅读理解

| ||
| ||

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:
铁是容易生锈的金属,世界上每年因腐蚀而报废的金属设备和材料相当于年产量的20%~40%。
⑴同学们用下图所示装置探究铁生锈的条件,将干燥的氧气通入A、B瓶内,大约经4~5min,A处的铁丝依然光亮,而B处的铁丝表面变暗,C中铁丝依然光亮。A、B进行对比,现象不同,说明铁生锈与 _____-___ 有关。
B、C处的现象对比说明,决定铁生锈快慢的一个重要因素是 。
⑵下列方法不能除去铁制品表面铁锈的是 ( )
A.用氢氧化钠溶液浸泡 B.用稀盐酸浸泡
C.用砂纸打磨 D.用厕所清洁剂(pH=1)洗
⑶请你列举一种防止铁生锈的措施 。
⑷实验室内将铁锈再生为铁,可利用下图所示装置,请回答:
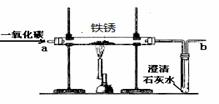
①实验前应该先通入CO,后加热,其目的是 。
②在装置b处再放置一盏燃着的酒精灯,其目的是 。
③铁锈的主要成分氧化铁再生为铁的化学方程式为 。
⑸学校实验室从校办厂拉回一桶含有FeSO4、CuSO4的废液,同学们想从中回收金属铜和硫酸亚铁晶体,设计了如下实验方案。结合实验方案回答下列问题:

步骤① 中,金属X是 ,步骤② 中,加入过量稀硫酸的目的是 ,证明步骤② 中硫酸已过量的以下方法合理的是 ( )
A.加入硫酸后,立即测出溶液的pH小于7 B.充分反应后,取少量溶液加铁时有气泡产生
C.充分反应后,取少量溶液滴加氯化钡溶液时有沉淀产生
查看答案和解析>>
科目:初中化学 来源:2013年江苏省盐城市东台实验中学中考化学模拟试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com