
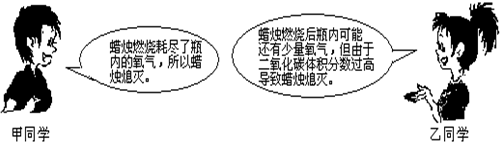
| 实验步骤 | 实验现象 | 实验分析 | 实验结论 |
(1)取一小块白磷,放在一铝箔制的小盒中,将其放入装有白色块状固体的锥形瓶内,点燃蜡烛,如图安装,观察现象.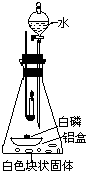 |
燃烧的蜡烛一会儿就熄灭了. | 白磷燃烧需满足的条件:①温度达到着火点. ②______. |
猜想正确的同学是: ______. |
| (2)待冷却后,打开分液漏斗活塞,向白色块状固体上注入适量水,立即关闭活塞,观察现象 | 铝盒中的白磷燃烧,放出热量的同时还产生了______. |
| 实验步骤 | 实验现象 | 实验分析 | 实验结论 |
②与氧气接触. |
乙. | ||
| 大量白烟 |


科目:初中化学 来源: 题型:阅读理解
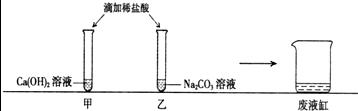
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
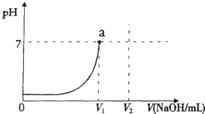 该选用
该选用

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| 实验步骤 | 实验现象 | 实验分析 | 实验结论 |
(1)取一小块白磷,放在一铝箔制的小盒中,将其放入装有白色块状固体的锥形瓶内,点燃蜡烛,如图安装,观察现象.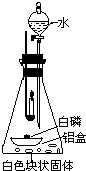 |
燃烧的蜡烛一会儿就熄灭了. | 白磷燃烧需满足的条件:①温度达到着火点. ② 与氧气接触 与氧气接触 . |
猜想正确的同学是: 乙 乙 . |
| (2)待冷却后,打开分液漏斗活塞,向白色块状固体上注入适量水,立即关闭活塞,观察现象 | 铝盒中的白磷燃烧,放出热量的同时还产生了 大量白烟 大量白烟 . |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com