
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ�Ҳ��ʵ�����г��õĻ�ѧ�Լ��������Ƕ���������ʡ���ȡ����;�ȷ����̽�������㹲ͬ���벢�ش��й����⡣
��̽��һ�����������
(1)̽��Ũ�����ijЩ���ԡ�
����Сľ��պȡ����Ũ���ᣬ����һ��ɹ۲쵽___��
��Ũ�����ϡ�ͣ�Ũ����ϡ������ͼ1��ʾ��b��ʢ�ŵ�������___��a��������___��
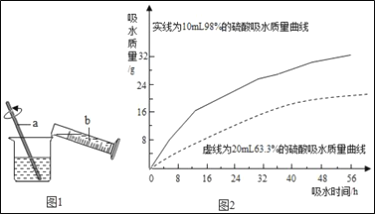
����ȤС���98%��Ũ����10ml��63.3%��������ҺԼ20mL�ֱ����������ͬ��С�ձ��У��������۲졢��¼���������������»�����ʵ������ݻ�ɵ�������ͼ2����ͼ2�������ܵõ���ʵ����ۣ�_____(д����)��
(2)̽��ϡ����Ļ�ѧ���ʡ�
��ͼ3��������ϡ����ֱ����A��E����ֻ�ձ��С�
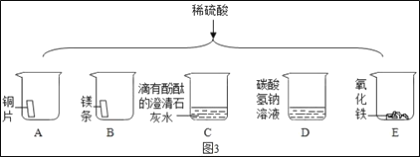
���в������ݵ���___(����ţ���ͬ)���а�ɫ�������ɵ���___��
����֤��C�з�����ѧ��Ӧ��������___��
(3)��д��ϡ�����һ����;___��
��̽����������Ĺ�ҵ�Ʒ���
��ҵ���Ի�����Ϊԭ����������Ĺ���������ͼ4��ʾ��
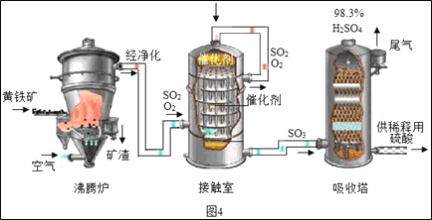
(1)�Ӵ����з����Ļ�ѧ����ʽΪ___��
(2)������������Ĺ�������ͼ������˵����ȷ����___(����ĸ���)��
A Ϊʹ��������ȼ�գ��轫����� B �����ܹ����SO2�ķ�Ӧ���ʺͲ���
C �������еõ��IJ�ƷΪ����� D ����¯�ų��Ŀ����ɹ�����
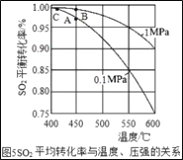
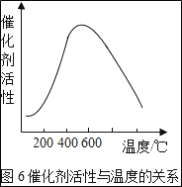
(3)�Ӵ����е�SO2ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ��ͼ5��ʾ�������������¶ȵĹ�ϵ��ͼ6����ʵ�������У�SO2��������Ӧ������ѡ��ѹ��450��(��Ӧͼ��A��)����û��ѡ��SO2ת���ʸ��ߵ�B��C���Ӧ�ķ�Ӧ��������ԭ��ֱ���___��___��
��̽������̽��ij��������FeS2�ĺ�����
ͬѧ�ǽ���������ʵ��̽����
���������ϣ���4FeS2 +11O2 ![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
��Na2SO3 +H2O2 ��Na2SO4 +H2O
��ʵ��̽����
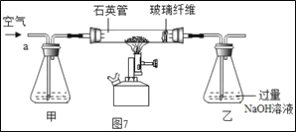
���ȡ1.60g��������Ʒ������ͼ7��ʾװ��(�г�װ��ʡ��)��ʯӢ���У���a�����ϵػ���ͨ���������������ʯӢ���еĻ�������Ʒ����ȫ��Ӧ��
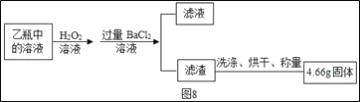
��Ӧ��������ƿ�е���Һ������ͼ8����
���������ۣ�
(1)I��װ�ü�ƿ��ʢ�ŵ��Լ�������������Һ����������___��II����Һ����������һ����___��
�������ⶨ��
(2)II�����յõ���4.66g������___(�ѧʽ)��
(3)����û�������FeS2����������Ϊ___��(д���������)
��������˼��
(4)���ȱ�ټ�װ�ã������ղ��FeS2��������������___(����ƫ������ƫС����������)
(5)���֤��II������BaCl2��Һ�ѹ���(���Ҫд����������������)___��
���𰸡�Сľ����� Ũ���� ���裬ʹ����������Ѹ����ɢ Ũ�����һ��Ũ�ȵ�ϡ���ᶼ������ˮ�� Ũ�����ϡ�������ˮ����ǿ BD E ��Һ�ɺ�ɫ��Ϊ��ɫ ����������⣬�ƻ��ʡ�ũҩ��Ⱦ�ϡ�ұ������������ʯ�͵� 2SO2+O2![]() 2SO3 ACD ��ѡB�㣬��ΪѹǿԽ���豸���ܺĵ�Ҫ��Ҳ�� ��ѡC�㣬��Ϊ�¶�Խ�ͣ������Ļ��Բ��ߣ���Ӧ���ʻ���� ���տ����е�CO2 NaCl��BaCl2��NaOH BaSO4 75% ƫ�� ���ϲ���Һ�м����μ�BaCl2��Һ�����������֣���BaCl2��Һ�ѹ���
2SO3 ACD ��ѡB�㣬��ΪѹǿԽ���豸���ܺĵ�Ҫ��Ҳ�� ��ѡC�㣬��Ϊ�¶�Խ�ͣ������Ļ��Բ��ߣ���Ӧ���ʻ���� ���տ����е�CO2 NaCl��BaCl2��NaOH BaSO4 75% ƫ�� ���ϲ���Һ�м����μ�BaCl2��Һ�����������֣���BaCl2��Һ�ѹ���
��������
[̽��һ]���������
��1��̽��Ũ�����ijЩ���ԡ�
��Ũ���������ˮ�ԣ���Сľ��պȡ����Ũ���ᣬ����һ��ɹ۲쵽Сľ����ڡ����Сľ�����
��Ũ�����ϡ�ͣ��ǽ�����뵽ˮ��ȥ�����Ҳ����ò��������裬����Ũ����ϡ����ͼʾ��b��ʢ�ŵ�������Ũ���ᣬa�Dz��������������ǽ��裬ʹ����������Ѹ����ɢ�����Ũ������裬ʹ����������Ѹ����ɢ
�۸���ͼ2���Եó���ʵ������У�Ũ�����һ��Ũ�ȵ�ϡ���ᶼ������ˮ�ԣ�Ũ�����ϡ�������ˮ����ǿ�� ���Ũ�����һ��Ũ�ȵ�ϡ���ᶼ������ˮ�ԣ�Ũ�����ϡ�������ˮ����ǿ��
��2��̽��ϡ����Ļ�ѧ���ʡ�
A��ͭ��ϡ���������Ӧ��B.þ����ϡ���ᷴӦ��������þ��������C.ϡ�������������Ʒ�Ӧ���������ƺ�ˮ��D.ϡ������̼�����Ʒ�Ӧ�����������ơ�������̼��ˮ��E.ϡ�������Ȼ�����Ӧ���ɰ�ɫ���������ᡣ
���в������ݵ���BD���а�ɫ�������ɵ���E�����BD��E
����֤��C�з�����ѧ��Ӧ����������Һ�ɺ�ɫ��Ϊ��ɫ�������Һ�ɺ�ɫ��Ϊ��ɫ
��3��ϡ�������;�н���������⣬�ƻ��ʡ�ũҩ��Ⱦ�ϡ�ұ������������ʯ�͵ȡ��������������⣬�ƻ��ʡ�ũҩ��Ⱦ�ϡ�ұ������������ʯ�͵�
[̽����]����Ĺ�ҵ�Ʒ���
��1���Ӵ����и�������ͼ��֪��ͨ���SO2��O2 ������Ӧ��������SO3 ��SO3�������������������Ļ�ѧ����ʽΪ2SO2+O2![]() 2SO3�����2SO2+O2
2SO3�����2SO2+O2![]() 2SO3
2SO3
��2��A Ϊʹ��������ȼ�գ��轫����飬ʹ������������ĽӴ��������Ӧ����֡��ʷ������⣻
B ����ֻ�ܸı䷴Ӧ���ʣ����ܹ����SO2�ķ�Ӧ���ʺͲ������ʲ��������⣻
C �������еõ��IJ�ƷΪ��Ũ�ȵ����ᣬ������ˮ�����ڻ����ʲ��������⣻
D �������У�������Ԫ�أ���ȼ�չ����в����˺����Ŀ���������¯�ų��Ŀ����ɹ��������������⣻���ACD
��3�����ݽӴ����е�SO2ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵͼʾ�������������¶ȵĹ�ϵͼʾ����ʵ�������У�SO2��������Ӧ������ѡ��ѹ��450������Ӧͼ��A�㣩����û��ѡ��SO2ת���ʸ��ߵ�B��C���Ӧ�ķ�Ӧ��������ԭ��ֱ��ǣ���ѡB�㣬��ΪѹǿԽ���豸���ܺĵ�Ҫ��Ҳ��ѡC�㣬��Ϊ�¶�Խ�ͣ������Ļ��Բ��ߣ���Ӧ���ʻ������
[̽����]̽��ij��������FeS2�ĺ�����
[��������]
��1��I��װ�ü�ƿ��ʢ�ŵ��Լ�������������Һ�������������տ����е�CO2����ֹ�Ժ���ʵ�����Ӱ�졣������տ����е�CO2
II��������ͼ�����ɵã�������ƿ�е��������ƹ���������ƿ�е�����ΪNaOH��Na2SO3�����������Ĺ����������������ת��Ϊ�����ƣ�����������Ȼ�����Һ���Ȼ����������Ʒ�Ӧ�������ᱵ�������Ȼ��ƣ�����Һ����������һ����NaCl��BaCl2��NaOH�����NaCl��BaCl2��NaOH
[�����ⶨ]
��2��II������Ϊ���ᱵ�����յõ���4.66g������BaSO4�����BaSO4
��3�����������غ㶨�ɣ���Ԫ��ת��������ϵ���£��������FeS2������Ϊx��
![]()
![]()
�û�������FeS2����������Ϊ��![]() �����75%
�����75%
[������˼]
��4����װ�������տ����еĶ�����̼�ģ����ȱ�ټ�װ�ã���װ�������̼���ƣ�̼���ƿ��Ժ��Ȼ�����Ӧ����̼�ᱵ������ʹ�ò����ij����������������ղ��FeS2��������������ƫ���ƫ��
��5��֤��II������BaCl2��Һ�ѹ����������ϲ���Һ�м����μ�BaCl2��Һ�����������֣���BaCl2��Һ�ѹ�����������ϲ���Һ�м����μ�BaCl2��Һ�����������֣���BaCl2��Һ�ѹ���


 ��Կ���Ծ�ϵ�д�
��Կ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH4Cl��Na2SO4���ܽ�ȱ����ܽ���������¡�����˵����ȷ����
�¶�/�� | 10 | 20 | 30 | 40 | 50 | 60 | |
�ܽ�� S/g | NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |
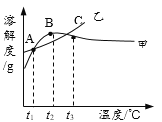
A. ��ΪNH4Cl
B. t3��Ӧ����30����40��
C. �����ʵı�����Һ��t2���µ�t3����Һ������������������
D. �ס��ұ�����Һ��t3���µ�t1���������壨�������ᾧˮ��������һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����������ұ�ί�������ŷ�����WTO�ݽ�֪ͨ��������2017��9�����й�����ֹ�����йء�������������ͼ���ٻ�����Ⱦ�����·�庬�����½�����Sn��Pb��Cu��Ag��Ni����������ɫ����Pd���٣�����ɫ������������գ�������Դ�˷ѣ��ֻ���ɻ�����Ⱦ����ͼ�ǻ������в��ֽ���������ͼ������������ͼ�и���Ӧ��ǡ����ȫ��Ӧ����֪��2Cu+O2+2H2SO4![]() 2CuSO4+2H2O��
2CuSO4+2H2O��

��1��д����ɫ����A������_____��
��2������2�к��еĽ�����_____��
��3����������Ӧ�Ļ�ѧ����ʽ_____��
��4�����������յĴ�����B��_____��д��ѧʽ����
��5������Ni�Ļ�Ա���_____���ǿ������������
��6���������������������У�ʹ�ô������IJ���������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ������CuSO4��CaCO3��Ba(NO3)2��Na2SO4��NaOH�е�һ�ֻ��֣�Ϊȷ������ɣ�ͬѧ�ǽ���������ʵ�飮
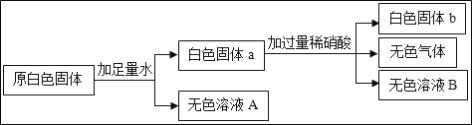
(1)ԭ������һ��û��___��
(2)ʵ������в�������Ļ�ѧ����ʽΪ___��
(3)��ɫ��ҺB�е�������___��
(4)ԭ�����п��ܴ��ڵ�������___��Ҫȷ�����Ƿ���ڣ�������е�ʵ����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ�����г���������һЩ����ͬѧ�Ƿ��ֽ�CO2ͨ��NaOH��Һʱû�����Ե���������Ϊ�ˣ����ǽ���������̽����
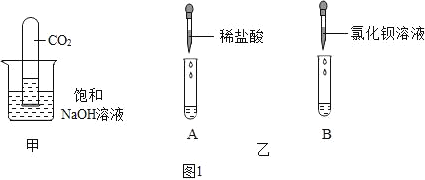
��1��С����һ֧�ռ���CO2���Թܵ�����ʢ�б���NaOH��Һ���ձ��У���ͼ����ʾ�����۲쵽�Թ���Һ��������ԭ����_____���û�ѧ����ʽ��ʾ�������۷�����ͬѧ����Ϊ�����Թ���Һ������������һ��ԭ�����Ҫ˵����_____��
��2��Ϊ�˽�һ��ʵ��CO2��NaOH��Һȷʵ�����˷�Ӧ��С����������·������ֱ�ȡ����ʵ������Һ��A��B��֧�Թ��У���ͼ����ʾ�������Թ�A�еμ�������ϡ���ᣬ�۲쵽��������_____����Ӧ�Ļ�ѧ����ʽΪ_____�����Թ�B�еμ��Ȼ�����Һ���۲쵽��������_____����Ӧ�Ļ�ѧ����ʽΪ_____����Ȼʵ�������ͬ��������֤��CO2��NaOH��Һȷʵ�����˻�ѧ��Ӧ��
��3��ʵ���������Ҫ����CO2ʱ������ѡ��NaOH��Һ�����ǣ�����CO2ʱ����ѡ�������Ƶij���ʯ��ˮ�����Ҫ����ԭ��_____��
��4��ij��ѧ��ȤС����ʵ������̼������Һ����ʯ����ȡ��������������Һ�����ǵ�ʵ����̺����������ͼ2��ʾ������㣺
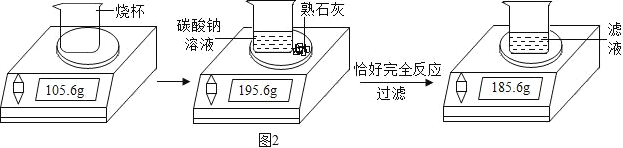
��ʵ�������ɳ�����������_____g��
����������������Һ�����ʵ���������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ȤС���ͬѧ��ѧ���׳�Ϊ�մ��̼���ƺ�֪������һ���׳�ΪС�մ�ġ��ֵܡ���������ֵܡ��������Ƿ�������ƣ�����֮���ܷ���ת����
С�����������ϣ��������Ϣ���������
���� | �մ� ���� | С�մ� |
��ѧʽ | Na2CO3 | NaHCO3 |
������ | Na+ CO32�� | Na+ HCO3�� |
�ܽ�ȣ����£� | 21.5�� | 9.6�� |
���ߵ�ת�� | Na2CO3+CO2+H2O�T2NaHCO3 | 2NaHCO3 |
������С��ͬѧ���е�̽����
��1�����Թ�ȡ����NaHCO3��Һ�����Թ��еμӷ�̪��Һ���۲���Һ��ɫ�仯����ʵ���Ŀ���� ��
��2�����о�Na2CO3��NaHCO3ת��ʱ��С������Na2CO3ת��ΪNaHCO3�����У�����NaHCO3����ˮ���������̲�����������������ʦЦ�Ŷ�С��˵������ʵ��ɣ�ʵ�����������������С������ʦ��ָ���£��͵�Na2CO3��Һ��ͨ��CO2��������������������ϵ�ͨ��CO2����Һ�г����˰�ɫ����������С�����ɻ�NaHCO3����ˮ��Ϊʲô���а�ɫ�����أ�С������˼���������˰�ɫ����������ԭ���� ��
��3����С��ͬѧ�Ĵ����£���ȤС���ֶ�NaHCO3���������ʽ�����̽�������������ֵܡ��������Ƶ�����Ҳ�в�ͬ�ĸ��������۽Ƕȷ�������������ֵܡ���ͬ���Ե�ԭ���� ��ͬ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��������FeCO3������ȡ��Ѫ����ԭ�ϣ��������û�ͭ���Һ[���ʳɷ�ΪFe2��SO4��3��CuSO4��H2SO4]Ϊԭ�ϣ��Ʊ�̼������������ͭ����������ʾ��ͼ��
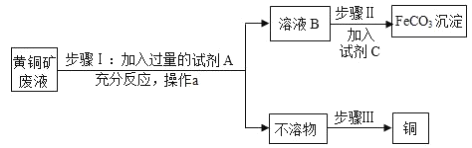
��֪����Fe��Fe2��SO4��3��Һ�ܷ�����Ӧ����FeSO4����ҺB��ֻ��һ�����ʡ�
��1������1�У��Լ�AΪ_____���������A��Ŀ����ʹ��Һ��Fe2��SO4��3��CuSO4��H2SO4ȫ��ת��Ϊ_____����Ӧ�����й۲쵽������֮һ���к�ɫ����������д���÷�Ӧ�Ļ�ѧ����ʽ_____��
��2������a�����ƣ�_____��
��3��������У��Լ�C�Ļ�ѧʽ����Ϊ_____�ȿ�����̼���Ρ�
��4��������Ŀ���ǣ���ȥ�����������е���һ�ֽ��������յõ������������ͭ���û�ѧ��������ͭ�IJ�������Ϊ�����������ϡ������ᡢ���ˡ�ϴ�ӡ��������ͭ����������Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����3�֣���ͼ��ʾΪ������آ��Ȼ��Ƣ����ᣨH3BO3�����ܽ������ͼ����ͼ��֪��
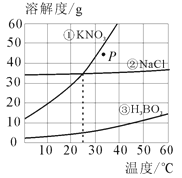
��1�����¶�Ϊ10��ʱ������ء��Ȼ��ƺ������������ʵ��ܽ����С�����˳��Ϊ ������������𣩡�
��2�����¶�Ϊ25��ʱ�������������ʵı�����Һ�У����ʵ�����������С�����˳��Ϊ ������������𣩡�
��3��Ҫ��P�㴦���������Һ��ɱ�����Һ���ɲ�ȡ�Ĵ�ʩ�У���������ع��塢 ����дһ�����ȡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij¶���ڿ����е�CaO���壬�������CaԪ����������Ϊ50%��ȡ10g��CaO������Ʒ�������м�������ϡ����ʹ����ȫ�ܽ⡣��ȷ��˵����(����)
A. ����ϡ�����һ��û�����ݲ���
B. ��CaO��Ʒ�ijɷֿ�����CaO��Ca(OH)2
C. ����CaCl2������Ϊ11.1g
D. ��CaO��Ʒ�ijɷֿ�����Ca(OH)2��CaCO3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com