
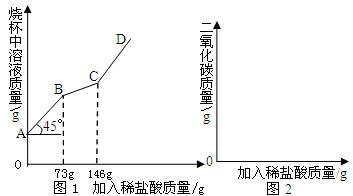
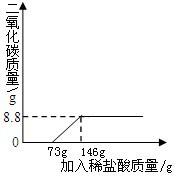
 解:(1)开始的45°夹角,说明加入的溶液的质量等于溶液质量增加量,说明过程中无气体或者沉淀产生.当加入73g稀盐酸时,开始放出气体二氧化碳;当稀盐酸的量达146g时,放出二氧化碳气体达最大值;以后再加稀盐酸,不再放出二氧化碳气体;
解:(1)开始的45°夹角,说明加入的溶液的质量等于溶液质量增加量,说明过程中无气体或者沉淀产生.当加入73g稀盐酸时,开始放出气体二氧化碳;当稀盐酸的量达146g时,放出二氧化碳气体达最大值;以后再加稀盐酸,不再放出二氧化碳气体; =
=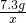
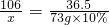


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com