
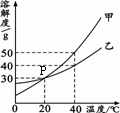
 甲、乙两种固体物质的溶解度曲线如右图所示.
甲、乙两种固体物质的溶解度曲线如右图所示.
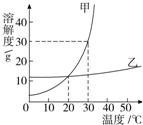
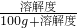 ×100%,可得饱和溶液中溶质的质量分数取决于该温时的溶解度,而40℃甲的溶解度大于乙的溶解度,所以其溶质质量分数甲大于乙;60g放入100g水中升温至40℃,此时乙的溶解度为40g,依据溶解度的定义,100g水中最多可溶40g乙,剩余20g乙不能溶解,即溶质质量与溶剂质量之比为:40g:100g=2:5.故答案为:>2:5;
×100%,可得饱和溶液中溶质的质量分数取决于该温时的溶解度,而40℃甲的溶解度大于乙的溶解度,所以其溶质质量分数甲大于乙;60g放入100g水中升温至40℃,此时乙的溶解度为40g,依据溶解度的定义,100g水中最多可溶40g乙,剩余20g乙不能溶解,即溶质质量与溶剂质量之比为:40g:100g=2:5.故答案为:>2:5;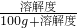 ×100%,可得饱和溶液中溶质的质量分数取决于该温时的溶解度,而B与E溶液均为20℃时的饱和溶液,溶解度相同,则其溶质质量分数也相同.故答案为:AC E
×100%,可得饱和溶液中溶质的质量分数取决于该温时的溶解度,而B与E溶液均为20℃时的饱和溶液,溶解度相同,则其溶质质量分数也相同.故答案为:AC E

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
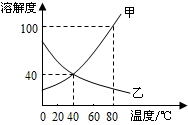
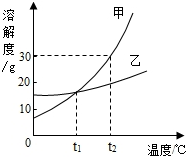 右图是甲、乙两种固体物质的溶解度曲线.下列说法正确的是( )
右图是甲、乙两种固体物质的溶解度曲线.下列说法正确的是( )| A、甲的溶解度随温度变化比乙小 | B、t2℃时甲的饱和溶液的溶质质量分数小于30% | C、t1℃时,甲、乙饱和溶液的溶质质量分数不相等 | D、可采用降低温度的方法使乙的饱和溶液变为不饱和溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 ?
?查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com