(2002?兰州)(1)将一包有氢氧化铜、氧化铜和锌粒组成的混合物,投入过量的稀硫酸中,充分反应后,发现有少量的不溶物.此物质为红色,请写出上述反应的化学方程式:
①______
②______
③______
④______
(2)按下列要求写出反应的化学方程式:
①两种黑色固体物质混合后,在高温条件下反应生成红色物质______ CO2+Cu
【答案】
分析:(1)根据各类物质的性质判断,氢氧化铜属于碱,氧化铜属于金属氧化物,锌属于金属,都能和酸反应,同时,反应后溶液中红色不溶物,说明金属与盐溶液发生了置换反应.
(2)根据反应特点和物质的颜色判断出反应物或生成物,然后根据质量守恒定律书写化学方程式.
解答:解:(1)此题主要考查稀硫酸的化学性质,氢氧化铜、氧化铜、锌都能和酸反应,反应后,有少量不溶于水的红色物质,应为铜.这是由锌与CuSO
4反应生成的;
故答案为①Cu(OH)
2+H
2SO
4=CuSO
4+2H
2O
②CuO+H
2SO
4=CuSO
4+H
2O
③Zn+H
2SO
4=ZnSO
4+H
2↑
④Zn+CuSO
4=ZnSO
4+Cu
(2)按下列要求写出反应的化学方程式:
①两种黑色固体物质混合后,在高温条件下反应生成红色物质,红色物质为铜时,木炭和氧化铜都是黑色的,高温下能发生还原反应,化学方程式为:C+CuO
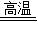
CO
2+Cu;
②有红褐色沉淀是氢氧化铁,氢氧化钠和氯化铁反应可以生成氢氧化铁,化学方程式为:3NaOH+FeCl
3═Fe(OH)
3↓+3NaCl;
③有蓝色沉淀是氢氧化铜,蓝色溶液可以是硫酸铜,根据复分解反应的特点,化学方程式为:2NaOH+CuCl
2═Cu(OH)
2↓+2NaCl,CuO+H
2SO
4═SuSO
4+H
2O.
故答案为:C+CuO
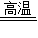
CO
2+Cu;
②3NaOH+FeCl
3═Fe(OH)
3↓+3NaCl;
③2NaOH+CuCl
2═Cu(OH)
2↓+2NaCl,CuO+H
2SO
4═CuSO
4+H
2O.
点评:能根据反应物和反应类型判断生成物和反应条件,是书写化学方程式的基本功,要按照书写化学方程式的步骤,正确完整的书写化学方程式.

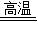 CO2+Cu;
CO2+Cu;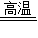 CO2+Cu;
CO2+Cu;