
某研究型学习小组的同学在用浓硫酸测定废锌片中锌的纯度时,没有将浓硫酸稀释直接处理废锌片发现产生的气体具有刺激性气味(废锌片中其它杂质不与硫酸反应),这种现象引起同学们的思考和研究。
【提出猜想】对产生的气体进行猜想:
猜想1:只有H2;
猜想2:只有SO2;
猜想3:可能是
小华认为不需做实验根据已有知识就可知道猜想1是错误的,他的依据是 。
【资料】①浓硫酸有强氧化性,其与活泼金属反应不生成氢气,② SO2能使品红溶液褪色
【实验方案】研究性学习小组的同学设计下图所示的装置进行研究(夹持仪器已省略,假设装置中的反应都进行完全)。
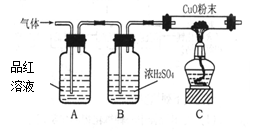
根据实验现象小组得到共同结论是猜想3成立。
(1) 他们的实验现象是
装置B中浓硫酸的作用是 (2)小华对实验结果产生疑问:
你认为小华产生疑问的依据是
你认为猜想3成立可能原因是:
【拓展应用】
(1)稀硫酸与锌反应能产生氢气(Zn+H2SO4=ZnS04+H2 ↑),而浓硫酸与锌反应开始时不产生氢气(Zn+(浓)2H2SO4=ZnS04+SO2↑+2 ),
由此可知反应物相同,但 不同生成物也不同。
(2)取废锌片8g(废锌片中其它杂质不与硫酸反应)加入足量浓硫酸至固体质量不再减少为止,过滤,将滤液蒸干共得晶体16.1g,此废锌片的纯度是 。
(3)如果用浓硫酸来直接测定废锌片中锌的纯度时,尾气必须处理,可将尾气通入足量的石灰水里其反应方程式是 。
【提出猜想】 H2和SO2 , 氢气没有刺激性气味
(1)【实验方案】他们的实验现象是A中品红溶液褪色C中黑色固体变成红色
装置B中浓硫酸的作用是 干燥进入C中的气体 (2)你认为小华产生疑问的依据是 浓硫酸有强氧化性,其与活泼金属反应
不生成氢气
你认为可能原因是: 反应过程中消耗硫酸浓硫酸逐渐变成稀硫酸
【思维拓展】(1) H2O , 浓度 。
(2) 81.25% 。
(3) Ca(OH)2+SO2=CaSO3↓+ H2O 。
解析:【提出猜想】因为闻到有刺激性气味,而氢气没有刺激性气味,所以不可能就是氢气一种。
【实验方案】SO2能使品红溶液褪色,氢气能还原氧化铜,所以二者都有的话实验现象为A中品红溶液褪色C中黑色固体变成红色,浓硫酸有吸水性,所以可以干燥进入C中的气体。
(2)因为由资料可知浓硫酸有强氧化性,其与活泼金属反应不生成氢气,但是随着反应,浓硫酸会变成稀硫酸。
【思维拓展】(1)根据反应前后原子的种类和个数不变既可以得出。因为稀硫酸产生氢气,而浓硫酸生成的是水,所以反应物的浓度不同生成物也不同。
(2)得到的晶体16.1g为硫酸锌,所以可以根据化学方程式通过生成16.1克硫酸锌求出锌的质量为6.5克,所以此废锌片的纯度是6.5/8=81.25%
(3)二氧化硫与石灰水反应方程式为Ca(OH)2+SO2=CaSO3↓+ H2O


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:初中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:初中化学 来源: 题型:
 某研究型学习小组的同学在用浓硫酸处理废锌片时发现产生的气体具有刺激性气味,这种现象引起同学们的思考和研究.
某研究型学习小组的同学在用浓硫酸处理废锌片时发现产生的气体具有刺激性气味,这种现象引起同学们的思考和研究.查看答案和解析>>
科目:初中化学 来源: 题型:


查看答案和解析>>
科目:初中化学 来源:2011-2012学年山东省乐陵市第一次练兵考试化学试卷 题型:探究题
某研究型学习小组的同学在用浓硫酸处理费锌片时发现产生的气体具有刺激性气味,这种现象引起同学们的思考和研究。
【提出猜想】对产生的气体进行猜想:
猜想1:可能是H2;
猜想2:可能是SO2;
猜想3:可能是
 【查阅资料】SO2易溶于水,能与NaOH溶液反应生成Na2SO3。
【查阅资料】SO2易溶于水,能与NaOH溶液反应生成Na2SO3。
【实验方案】研究性学习小组的同学设计右图所示的装置进行研究(夹持仪器已省略,假设装置中的反应都进行完全)。
【问题讨论】
(1)如果装置A中没有明显现象,装置C中的现象为 则猜想 成立。
(2)如果装置A中的现象为 ,装置C中没有明显的现象则猜想 成立。
(3)猜想3成立的实验现象是
(4)装置B中浓硫酸的作用是 。
【思维拓展】
(1) 实验室中可以用氢氧化钠溶液吸收二氧化硫,反应的化学方程式是
。
 (2)小组内一同学又设计了判断SO2与NaOH溶液能否反应的装置(如右图),实验时发现试管内液面上升,就得出SO2与NaOH溶液反应的结论,其同学认为这一结论不严谨,理由是
。要得到科学严谨的结论,仍利用该装置,需做的对比实验是
(2)小组内一同学又设计了判断SO2与NaOH溶液能否反应的装置(如右图),实验时发现试管内液面上升,就得出SO2与NaOH溶液反应的结论,其同学认为这一结论不严谨,理由是
。要得到科学严谨的结论,仍利用该装置,需做的对比实验是
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com