
5.6 g某金属和足量稀硫酸充分反应后,生成二价金属化合物,同时有0.2 g氢气逸出,则该金属是
A.铁
B.锌
C.钙
D.铝
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:初中化学 来源: 题型:阅读理解
 都在5%以上.请设计实验探究该粉末中铁、铜的存在.
都在5%以上.请设计实验探究该粉末中铁、铜的存在.| 实验步骤 | 实验操作(说明仪器和试剂) | 实验现象 | 结论 |
| ① | 取少许粉末放入大试管中,再滴加 足量(或过量)的NaOH溶液 足量(或过量)的NaOH溶液 ,充分反应后,静置,弃去清液得到固体. |
固体粉末 部分溶解 部分溶解 ,有 气泡放出 气泡放出 . |
仅除去铝 |
| ② | 再往大试管中加 足量(或过量)的稀硫酸(或稀盐酸) 足量(或过量)的稀硫酸(或稀盐酸) ,充分反应. |
固体 部分溶解并有气泡放出 部分溶解并有气泡放出 ,溶液 呈浅绿色 呈浅绿色 . |
证明含有铁 |
| ③ | 将大试管静置,弃去上层清液,加水,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
| 加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
| 剩余固体的质量/g | 1 6.5 | n | 9.5 | … |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
大龙在公园看到绿化工人往树干上涂抹具有杀菌杀虫作用的悬浊液,对其成份产生了好奇,于是他带回了一些样本进行研究。
信息提示:许多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这叫做焰色反应。如:钠——黄色;钙——砖红色;钾——紫色;钡——黄绿色
Ⅰ猜想与假设:该制剂可能为波尔多液
Ⅱ实验探究:
| 序号 | 实验步骤 | 实验现象 |
| ① | 取样,将其置于大试管中,加入一定量水,静置片刻 | 上层有黄色固体漂浮,中层为无色液体,下层有较多白色固体 |
| ② | 取少量中层液体滴加无色酚酞试液 | 无色酚酞试液变红 |
| ③ | 另取少量中层液体进行焰色反应 | 火焰呈现砖红色 |
| ④ | 取少量黄色固体灼烧 | 燃烧,放热,产生淡蓝色火焰,有刺激性气味 |
| ⑤ | 向下层白色固体中滴加足量稀盐酸 | 固体完全溶解,但仅产生少量气泡 |
Ⅲ实验结论:
(1)根据上述实验①,可以判断该悬浊液中 ▲ (填“含”或“不含”)硫酸铜;
(2)根据上述实验 ▲ (填序号),可以判断该悬浊液中含有氢氧化钙;
(3)根据上述实验④,可以判断黄色固体是 ▲ ;
(4)写出⑤中发生的所有反应的化学方程式: ▲ 。
答案:(1)不含 (2)②③ (3)硫(或硫磺)(各1分)
(4)Ca(OH)2+2HCl=CaCl2+2H2O CaCO3+2HCl=CaCl2+H2O+C02↑(各2分)
4.(2009常州市)小黄用右图装置测定铜锌合金中锌的质量分数和锌的相对原子质量。主要实验步骤如下(必要的固定装置已略去):

①连接装置并检查装置气密性;
②加入药品和水;
③记录C中液面刻度(C为带有刻度的玻璃管);
④由A向B中滴加试剂至过量;
⑤待B中不再有气体产生并恢复至室温后,记录C中液面刻度,计算得到气体的体积为V mL(经查,该气体密度为ρg/L);
⑥将B中剩余固体过滤、洗涤、干燥并称重,称得剩余固体质量为W g。
(1)A仪器的名称为 ▲ ;
(2)B中发生的反应的化学方程式为: ▲ ;
(3)小黄在实验前将块状的铜锌合金磨成粉末状,其目的是: ▲ ;
(4)如何检验该装置的气密性: ▲ ;
(5)为使测得的气体体积更精确,记录C中液面刻度时,除使视线与凹液面的最低处相平外,还应 ▲ ;
(6)小黄发现实验中由于缺少某一步骤导致数据缺乏而无法计算,该步骤是: ▲ ;
(7)通常实验前须估算药品用量,如果实验过程中,发现盐酸的量不足,应中途加酸还是重新实验: ▲ ;理由是 ▲ 。
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
已知某混合金属粉末中除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计实验探究该粉末中铁、铜的存在。
资料在线:铝与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(2Al+2H2O+2NaOH=
2NaAlO2+3H2↑),铁和铜不与氢氧化钠溶液反应。
可供选择的实验用品:烧杯、大试管 、量筒、滴管、燃烧匙、药匙、磁铁;
、量筒、滴管、燃烧匙、药匙、磁铁;
稀硫酸、稀盐酸、Na0H溶液、氨水。
请你参与并完成以下实验探究过程:
I、提出假设
(1)假设1:该混合金属粉末中除铝外还含有Fe。
(2)假设2:该混合金属粉末中除铝外还含有 ▲ 。
(3)假设3:该混合金属粉末中除铝外还含有Fe、Cu。
II、设计并实施实验方案
(4)基于假设1,不用化学试剂,证明金属铁的存在可用 ▲ 。
(5)基于假设2,将混合金属粉末加入足量稀盐酸,你观察到的现象是 ▲ 。
(6)基于假设3,请你完成实验操作,描述实验现象。
| 实验步骤 |
| 实验现象 | 结论 |
| ① | 取少许粉末放入大试管中,再滴加 ▲ ,充分反应后,静置,弃去清液得到固体。 | 固体粉末 ▲ , 有 ▲ 。 | 仅除去铝 |
| ② | 再往大试管中加 ▲ ,充分反应。 | 固体 ▲ , 溶液 ▲ 。 | 证明含有铁 |
| ③ | 将大试管静置,弃去上层清液,加水,多次洗涤剩余固体 | 剩余固 | 证明含有铜 |
III、已知该金属粉末的组成为铝、铁和铜
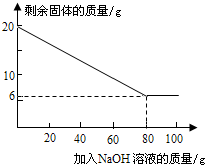
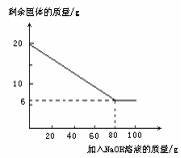
(7)为测定混合金属粉末中铝的质量分数,取20 g该金属粉末,把100 g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量。实验过程中得到的部分数据与图象如下:
| 加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
| 剩余固体的质量/g | 1 6.5 | n | 9.5 | … |
①分析以上数据可知,上表中n的值为 ▲ ;
②该金属粉末中Al的质量分数为 ▲ %;
③列式计算:所用氢氧化钠溶液的溶质质量分数为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com