
【题目】如图利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,将产生氨气。立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )
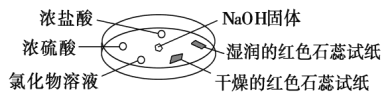
选项 | 实验现象 | 解释 |
① | 浓盐酸附近产生白烟 | NH3与HCl反应生成了NH4Cl固体 |
② | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
③ | 氯化物溶液中有红褐色沉淀 | 该溶液一定有FeCl3溶液 |
④ | 干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
A.②③④
B.①③④
C.①③
D.③④
科目:初中化学 来源: 题型:
【题目】我国化工专家侯德榜创立了“侯氏制碱法”,促进了世界制碱技术的发展。其流程简图和部分物质的溶解度曲线如下:
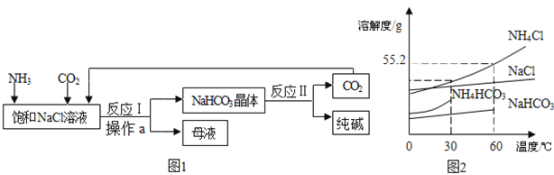
已知:①母液中有一种铵态氮肥
②![]()
请回答下列问题:
(1)操作a的名称是_____。
(2)结合图2分析,图1反应1中NaHCO3作为晶体析出的原因是_____,从图2中还能获得的一条信息是_____。
(3)图1中得到的母液中一定含有的阳离子是_____ (填离子符号), 流程中可以循环使用的物质是_____。
(4)从图2可以看出温度高于60°C,NaHCO3 的溶解度曲线“消失”了,其原因可能是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某课外活动中,学生利用如图所示的杠杆完成探究实验,杠杆已调至平衡。
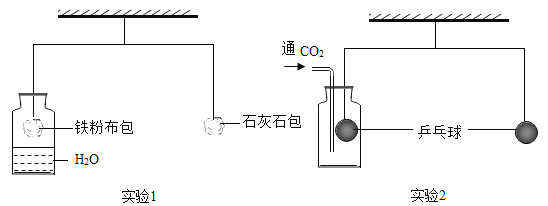
(1)实验1中,较长时间后,左边铁粉布包会____ (填“上升”或“下降”)下降,是因为铁粉与水、氧气发生了反应;
(2)将铁粉换成下列物质中的____ (填序号),杠杆也会出现相似现象。
A NaCl
B NaOH
C CaO
(3)实验2中,通入CO2一段时间,左边边乒乓球____ (填“上升”或“下降”);再往集气瓶中滴入足量NaOH溶液,杠杆重新平衡,其反应的化学方程式为___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列化学用语的描述不正确的是( )
A.N2、N2O3、NaNO2、NH4NO3、NH3五种物质中N元素化合价共有四种
B.α粒子是带2个正电荷、相对质量为4的单核微粒,其实就是He的原子核
C.某微粒核外电子排布示意图为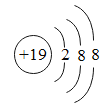 ,该微粒位于元素周期表第三周期
,该微粒位于元素周期表第三周期
D.符号Ar可以表示氩元素或氩气或1个氩原子
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图,A、B、C、D、E均为初中化学常见物质,它们存在如下转化关系,其中用“—”相连的表示两者可以反应,“→”表示生成的关系,一个字母代表一种物质。有部分生成物或反应物略去。
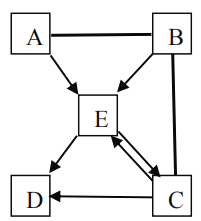
(1)若D和E为两种常见的金属单质,B、A是氧化物,E→C的化学方程式为_____。
(2)若C、D、E皆属于盐且都含有一种相同的元素、C在医疗上常用作补钙剂,B、E由两种元素组成,则E→C的化学方程式为_____,A物质的类别可能是_____(可多选:①单质②氧化物③碱④盐⑤酸)
(3)E→D可以生成一种难溶于稀硝酸的白色沉淀,写出反应方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室用铜和硫酸制取CuSO4有下列几种做法:
(1)甲学生进行了下列实验:取6.4g铜片和10mL某浓度的浓硫酸放在圆底烧瓶中共热,发现溶液慢慢变成蓝色,同时有刺激性气味气体生成。写出反应的化学方程式_____;直到反应完毕,最后发现烧瓶中还有铜片剩余。他根据自己所学的化学知识,认为烧瓶中还有较多的硫酸剩余。他这样认为的理由是:_____。
(2)乙同学认为甲设计的实验方案不好,他自己设计的思路是第一步:![]() 第二步:_____。对比甲的方案,乙同学的优点是_____、_____。
第二步:_____。对比甲的方案,乙同学的优点是_____、_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列是中学化学常用的仪器和装置,请回答:
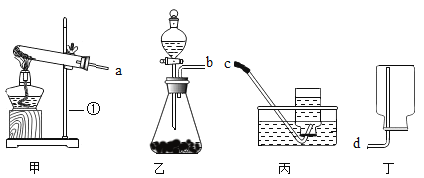
(1)仪器①的名称是______
(2)实验室用双氧水溶液和二氧化锰制取氧气应选择的制气装置为______(填“甲”或“乙”),该反应的化学方程式为______
(3)若以高锰酸钾固体为原料制取氧气,正确的接口连接顺序是____接____,实验前应先____,再加入药品。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中 Na2CO3 的质量分数。
(方案一) 称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:_______。
(2)实验中确定加热至恒重的方法是:______。
(方案二) 称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算。
(1) 实验中判断沉淀是否完全的方法是________。
(2) 实验中洗涤沉淀的操作是___________。
(方案三) 按如下图所示装置进行实验:
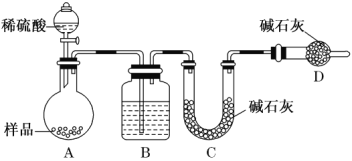
(1)B 装置内所盛试剂是________;
(2)实验前称取 17.90 g 样品,实验后测得 C 装置增重 8.80 g,则样品中 Na2CO3的质量分数为__________。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷,该缺陷是:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】绿矾(FeSO47H2O),在医药、净水、化肥、农药等方面有广泛的应用。化学小组的同学在用绿矾配制FeSO4溶液时发现,溶液颜色会由绿变黄,于是开展了以下探究活动。
(查阅资料)
ⅰ.FeSO4溶液如果长时间显露在空气中,会与氧气发生反应转换成Fe2(SO4)3 ,色泽由最初的浅绿色或淡绿色转变成黄色。反应生成的Fe2(SO4)3遇KSCN溶液会变红。
ⅱ.保存FeSO4溶液时要加入稀硫酸和铁钉,置于阴凉处。
(提出猜想)
影响FeSO4溶液与氧气反应速率的因素可能有温度、浓度、溶液酸碱性、是否有铁钉等。
(进行实验)
编号 | 实验 | 0min | 30min | 2h |
① |
| 溶液为浅绿色 | 溶液略显黄色 | 溶液黄色略有加深 |
② |
| 溶液为浅绿色 | 溶液明显变黄 | 溶液黄色明显加深 |
③ |
| 溶液立即变黄 | ||
④ |
| 溶液为浅绿色 | 溶液明显变黄,振荡后无变化 | 溶液黄色明显加深,振荡后无变化 |
⑤ |
| 溶液为浅绿色 | 溶液为浅绿色 | 溶液为浅绿色;滴加 KSCN溶液后, 略显红色 |
⑥ |
| 溶液为浅绿色 | 溶液为浅绿色 | 溶液为浅绿色;滴加 KSCN溶液后,略显红色,振荡后溶液变为浅绿色 |
(解释与结论)
(1)FeSO4溶液为浅绿色或淡绿色,Fe2(SO4)3溶液为黄色,可见这两种盐溶液的颜色差异与____元素有关。
(2)实验①中实验温度T=___℃
(3)通过对比实验②和③,得出的结论是 ___________。
(4)欲得出“稀硫酸和铁钉共同存在下才能有效防止FeSO4溶液变质”的结论,需要对比_______(填写实验编号)。
(5)实验⑤中,FeSO4溶液变质的反应如下,补全该反应的化学方程式。![]() ______
______
(6)下列说法正确的是________。
A 其他条件相同,溶液酸性增强,FeSO4溶液变质加快
B 其他条件相同,FeSO4溶液浓度越大,变质越快
C 实验⑥中,滴加KSCN 溶液后,略显红色,振荡后溶液变为浅绿色,可能是发生了反应![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com