(2004?淄博)某工厂的原料Fe2O3(粉末状)中混入了铜粉,现要测定混合物中的铜粉质量分数并将它们分离,请回答下列问题:
(1)如果要通过化学方法从混合物中分离得到Fe2O3和铜粉,请依次写出分离该混合物 操作中涉及的化学方程式(可选择的试剂是:硫酸溶液、硝酸银溶液、氢氧化钠溶液)______、______、______ Fe2O3+3H2O
【答案】
分析:(1)根据金属氧化物会与酸反应,而铜不会与酸反应,可以先将氧化铁溶解,在经过转化得到氧化铁进行分析;
(2)根据铜会与氧气生成氧化铜,铜会将盐溶液中的金属置换出来,氧化铁会与被还原出金属等反应原理,结合反应方程式中的比例关系以及反应前后质量的变化进行分析.
解答:解:(1)可以先将金属氧化物加酸溶解,过滤得到金属铜,然后将反应得到的铁的溶液转化成沉淀,再将沉淀加热得到氧化铁,铁和硫酸反应生成硫酸铁和水,故答案为:Fe
2O
3+3H
2SO
4=Fe
2(SO
4)
3+3H
2O;
硫酸铁和氢氧化钠反应氢氧化铁沉淀和硫酸钠,故答案为:Fe
2(SO
4)
3+6NaOH=2Fe(OH)
3↓+3Na
2SO
4;
氢氧化铁在加热的条件下生成氧化铁和水,故答案为:2Fe(OH)
3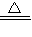
Fe
2O
3+3H
2O;
(2)方法一:铜在加热的条件下生成氧化铜,依据固体增加的质量,结合方程式计算出铜的质量,得到铜的质量分数,故答案为:A、B、H、G;
方法二:铜和硝酸银反应生成硝酸铜和银,依据置换出的银的质量,结合方程式计算出铜的质量,得到铜的质量分数,故答案为:A、D、E、I、G;
方法三:氧化铁和一氧化碳反应生成铁和二氧化碳,依据一氧化碳的质量,结合方程式计算出氧化铁的质量,然后得到铜的质量分数,故答案为:A、F、H、G.
点评:在解此类题时,依据需要分离的物质的性质,然后选择适当的试剂和方法,将需要分离的物质进行逐一分离,根据需要计算质量分数的物质的性质,选择适当的试剂和方法,利用方程式的比例关系进行计算.

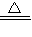 Fe2O3+3H2O;
Fe2O3+3H2O;

 阅读快车系列答案
阅读快车系列答案