
 实验室常用亚硝酸钠(NaNO2)与氯化铵溶液(NH4Cl)反应制取N2.N2的化学性质十分稳定,但在一定条件下能与H2部分化合生成NH3.下图为制取少量NH3并检验NH3的装置(制取H2的装置已略去):
实验室常用亚硝酸钠(NaNO2)与氯化铵溶液(NH4Cl)反应制取N2.N2的化学性质十分稳定,但在一定条件下能与H2部分化合生成NH3.下图为制取少量NH3并检验NH3的装置(制取H2的装置已略去): 2NH3.化学方程式的物质的质量比两物质的最佳质量比,为:14:3;由于是“部分化合”,仍会有未反应的H2和N2逸出.所以,D中导管口会逸出出气泡;由于氨气的水溶液显碱性.所以,验证有NH3生成的实验是:向D中滴入无色酚酞溶液,酚酞变红;
2NH3.化学方程式的物质的质量比两物质的最佳质量比,为:14:3;由于是“部分化合”,仍会有未反应的H2和N2逸出.所以,D中导管口会逸出出气泡;由于氨气的水溶液显碱性.所以,验证有NH3生成的实验是:向D中滴入无色酚酞溶液,酚酞变红;
 2NH3的各物质的质量比为28:6:34=14:3:17,N2的平均流量为1.4m g/s,H2的流量为0.3m g/s,N2和H2在反应中只能转化40%可知,生成NH3的平均流量为:1.7m g/s×40%=0.68m g/s;
2NH3的各物质的质量比为28:6:34=14:3:17,N2的平均流量为1.4m g/s,H2的流量为0.3m g/s,N2和H2在反应中只能转化40%可知,生成NH3的平均流量为:1.7m g/s×40%=0.68m g/s; 2NH3,得出锌与氨气的关系式为:
2NH3,得出锌与氨气的关系式为: 解得:X=7.8mg
解得:X=7.8mg 2NH3,14:3,会,向D中滴入无色酚酞溶液,酚酞变红;(3)见上图;(4)干燥氮气,干燥氢气;(5)①0.68m g/s; ②7.8mg.
2NH3,14:3,会,向D中滴入无色酚酞溶液,酚酞变红;(3)见上图;(4)干燥氮气,干燥氢气;(5)①0.68m g/s; ②7.8mg.

 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
| 颜 色 | 气 味 | 水 溶 性 | |
| 氮 气 |

| ||
| 高温高压 |
查看答案和解析>>
科目:初中化学 来源: 题型:
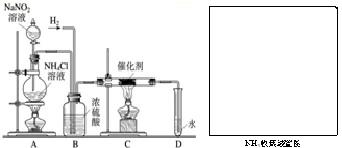 实验室常用亚硝酸钠(NaNO2)与氯化铵溶液(NH4Cl)反应制取N2.N2的化学性质十分稳定,但在一定条件下能与H2部分化合生成NH3.下图为制取少量NH3并检验NH3的装置(制取H2的装置已略去):
实验室常用亚硝酸钠(NaNO2)与氯化铵溶液(NH4Cl)反应制取N2.N2的化学性质十分稳定,但在一定条件下能与H2部分化合生成NH3.下图为制取少量NH3并检验NH3的装置(制取H2的装置已略去):
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:初中化学 来源:2011年江苏省扬州中学教育集团树人学校中考化学二模试卷(解析版) 题型:解答题

查看答案和解析>>
科目:初中化学 来源:2004年浙江省绍兴市中考化学试卷(解析版) 题型:填空题
| 颜 色 | 气 味 | 水 溶 性 | |
| 氮 气 |

 2NH3.现欲制取氨气1.7吨,理论上需要在0℃和标准大气压下的氮气多少升?(已知O℃和标准大气压下氮气的密度为1.25克/升;假设氮气完全转化为氨气)
2NH3.现欲制取氨气1.7吨,理论上需要在0℃和标准大气压下的氮气多少升?(已知O℃和标准大气压下氮气的密度为1.25克/升;假设氮气完全转化为氨气)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com