
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量剩余溶液,滴入氯化铜溶液 | 产生蓝色絮状沉淀 | 溶液中含有氢氧化钠 |
| ②将①中反应后混合物过滤,向滤液中加入足量稀硝酸再滴入几滴硝酸银溶液 | 产生白色沉淀 | 溶液中含有氯化钠 |
分析 根据水电解实验的原理、现象及产物检验进行分析,氧气可用带火星木条检验,氢气可用燃着的木条检验;
【定性研究】Ⅰ、根据质量守恒定律进行分析;
Ⅱ、①根据产生蓝色絮状沉淀为氢氧化铜进行分析;
②根据氯离子的检验进行分析;
【定量研究】(1)根据氢氧化钠的性质,氯化镁的性质进行分析;
(2)根据质量分数的计算进行分析;
(3)根据影响计算结果的因素进行分析.
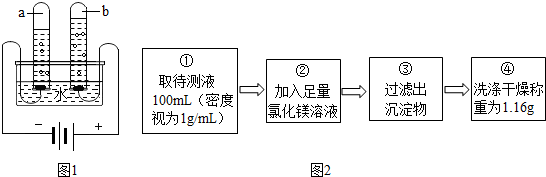
解答 解:电解水生成氢气和氧气,反应的化学方程式为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
电解水时,正极产生氧气,负极产生氢气,二者的体积比水1:2;b中气体体积小为氧气,能使带火星木条复燃;
【定性研究】Ⅰ、根据质量守恒定律,反应前后元素的种类不变,反应物中没有氮元素,所以不可能生成氨气;故填:根据质量守恒定律,反应前后元素的种类不变,反应物中没有氮元素,所以不可能生成氨气;
食盐水在通电时发生反应:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$↑NaOH+H2↑+Cl2↑,氯气是种有刺激性气味的有毒气体,所以该气体为氯气;
Ⅱ、①取少量剩余溶液,滴入氯化铜溶液,产生蓝色絮状沉淀,为氢氧化铜,所以溶液中含有氢氧化钠;故填:氢氧化钠;
②将①中反应后混合物过滤,向滤液中加入足量稀硝酸再滴入几滴硝酸银溶液,产生白色沉淀,为氯化银,说明溶液中含有氯离子;
在①的反应中氯化铜和氢氧化钠反应,生成氯化钠和氢氧化铜,生成物中有氯化钠,向滤液中加入足量稀硝酸再滴入几滴硝酸银溶液,产生白色沉淀,所以不能证明原溶液中含有氯化钠;故填:①的反应中氯化铜和氢氧化钠反应,生成氯化钠和氢氧化铜,生成物中有氯化钠,向滤液中加入足量稀硝酸再滴入几滴硝酸银溶液,产生白色沉淀,所以不能证明原溶液中含有氯化钠;
【定量研究】(1)氢氧化钠和氯化镁反应,生成氯化钠和氢氧化镁,加入氯化镁溶液必需足量,目的是使氢氧化钠完全反应;判断所加氯化镁溶液是否过量的具体操作:静置,取上层溶液,滴加氢氧化钠溶液,如果产生白色沉淀,说明氯化镁过量,如果没有明显现象,说明氯化镁不过量;故填:使氢氧化钠完全反应;取上层溶液,滴加氢氧化钠溶液,如果产生白色沉淀,说明氯化镁过量,如果没有明显现象,说明氯化镁不过量;
(2)设参加反应的氢氧化钠质量为x
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
80 58
x 1.16g
$\frac{80}{58}$=$\frac{x}{1.16g}$
x=1.6g
待测液中氢氧化钠的质量分数=$\frac{1.6g}{100g}$×100%=1.6%;
(3)若步骤④中缺少洗涤干燥的操作,会使氢氧化镁中含有杂质,使质量增大,从而使计算的氢氧化钠质量增大;故填:偏大;
故答案为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;O2;带火星的木条;
【定性研究】Ⅰ、根据质量守恒定律,反应前后元素的种类不变,反应物中没有氮元素,所以不可能生成氨气;
Ⅱ、①氢氧化钠;
②产生白色沉淀;①的反应中氯化铜和氢氧化钠反应,生成氯化钠和氢氧化铜,生成物中有氯化钠,向滤液中加入足量稀硝酸再滴入几滴硝酸银溶液,产生白色沉淀,所以不能证明原溶液中含有氯化钠;
【定量研究】(1)使氢氧化钠完全反应;取上层溶液,滴加氢氧化钠溶液,如果产生白色沉淀,说明氯化镁过量,如果没有明显现象,说明氯化镁不过量;
(2)设参加反应的氢氧化钠质量为x
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
80 58
x 1.16g
$\frac{80}{58}$=$\frac{x}{1.16g}$
x=1.6g
待测液中氢氧化钠的质量分数=$\frac{1.6g}{100g}$×100%=1.6%;
(3)偏大.
点评 明确水电解的原理、实验现象和结论解答本题关健


科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 结论及解释 |
| (1)取少量溶液A于试管中,向其中滴加足量的稀盐酸; | 有气泡产生 | 猜想①不成立 |
| (2)另取少量溶液A于试管中,向其中滴加足量的氯化钙溶液; | 产生白色沉淀 | 反应的化学方程式为: Na2CO3+CaCl2=CaCO3↓+2NaCl |
| (3)将步骤(2)所得的混合液静置,向上层清液中滴加无色的酚酞溶液. | 溶液呈红色 | 猜想② 成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 粗盐通过初步的处理可除去其中的难溶性杂质.
粗盐通过初步的处理可除去其中的难溶性杂质.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
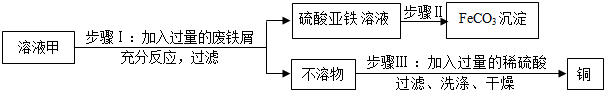
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 可用一种试剂除去KNO3溶液中混有的CuSO4 | |
| B. | 用一种试剂无法将NaOH、Na2CO3、NH4NO3、(NH4)2SO4四种无色溶液一次性鉴别开 | |
| C. | KNO3、HNO3、NaOH、Fe2(SO4)3四种溶液不用其他试剂也可鉴别开 | |
| D. | 向某无色溶液中加入稀盐酸,无现象,再加入BaCl2溶液产生白色沉淀,则说明无色溶液中一定含有SO42- |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
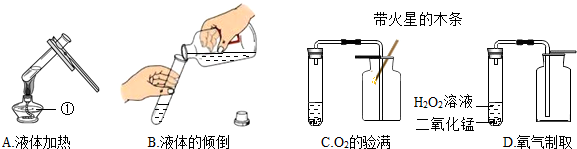
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 结合图回答下列问题.
结合图回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
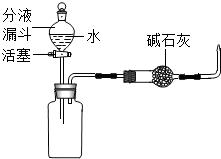 水田或池塘里常常不时地冒出一些气泡,几位同学决心弄清这种气泡的成分.请你与他们一起完成如下的探究.
水田或池塘里常常不时地冒出一些气泡,几位同学决心弄清这种气泡的成分.请你与他们一起完成如下的探究.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com