
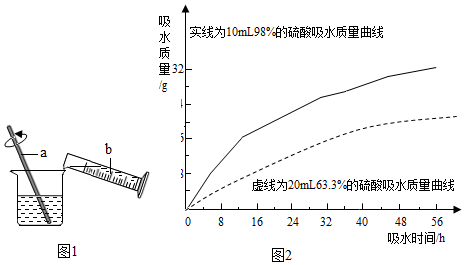
分析 (1)据浓硫酸具有脱水性分析;
(2)根据耨硫酸具有吸水性解答;
(3)根据浓硫酸的腐蚀性行分析.
(4)根据稀释浓硫酸的方法分析.
(5)①根据浓硫酸的稀释过程的操作要领分析解答;
②从曲线观察两种不同的酸的吸水情况的变化趋势分析解答.
解答 解:(1)浓硫酸具有脱水性,能够使物质发生碳化,故用小木棍蘸少量浓硫酸,放置一会儿后,可观察到小木棍蘸有硫酸的部位变黑;
(2)用温度计的液泡蘸取少量浓硫酸,放置在空气中一会儿,可观察到温度计显示温度升高,其原因是:浓硫酸具有吸水性,吸收空气中的水蒸气,浓硫酸溶于水放热;
(3)浓硫酸弄到手上后应立即用大量的水冲洗,然后涂上3%~5%的碳酸氢钠溶液;
(4)释浓硫酸时,一定要将浓硫酸沿烧杯壁缓慢地注入盛有水的烧杯里,并用玻璃棒搅拌,浓硫酸溶于水会放出大量的热,若用手轻轻触碰烧杯外壁,有热的感觉.故b中盛放的物质是浓硫酸,a的作用是搅拌、散热、降温.
(5)①浓硫酸的稀释时应酸入水并不断搅拌使溶解时产生的热量尽快散失;
②从曲线观察两种不同的酸的吸水情况的变化可知:浓硫酸和一定浓度以上的稀硫酸都具有吸水性;浓硫酸吸水能力比稀硫酸强(吸水速度快、吸水量大);开始两者吸水速度差异比较大,随着时间的推移吸水速度越来越接近,吸水能力越来越弱;硫酸浓度越稀吸水性越弱,到一定浓度后就失去吸水性;硫酸吸水能力可能会受环境温度、湿度、气压、酸的用量、表面积等因素的影响等.
故答案是:
(1)木棍变黑;(2)浓硫酸具有吸水性,吸收空气中的水蒸气,浓硫酸溶于水放热;
(3)大量的水冲洗; 涂上3%~5%的碳酸氢钠溶液;(4)浓硫酸;搅拌、散热、降温.
(5)①浓硫酸,水; ②浓硫酸和一定浓度以上的稀硫酸都具有吸水性;浓硫酸吸水能力比稀硫酸强(吸水速度快、吸水量大);开始两者吸水速度差异比较大,随着时间的推移吸水速度越来越接近,吸水能力越来越弱;硫酸浓度越稀吸水性越弱,到一定浓度后就失去吸水性;硫酸吸水能力可能会受环境温度、湿度、气压、酸的用量、表面积等因素的影响等.
点评 该题属于实验方案的探究题,主要是采用对比实验的方法对实验中的问题进行探讨,掌握设计实验的目的及方法是解题的关键所在.


 计算高手系列答案
计算高手系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁丝在空气里剧烈燃烧,火星四射,有黑色物质生成 | |
| B. | 蜡烛在氧气中燃烧时,生成水和二氧化碳 | |
| C. | 红磷在空气中燃烧,发出白色火焰,生成白色粉末 | |
| D. | 硫在氧气中燃烧,发出明亮的蓝紫色火焰 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 46% | B. | 44% | C. | 50% | D. | 55% |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 酒精灯着火---用湿抹布盖灭 | B. | 油锅起火---用锅盖盖灭 | ||
| C. | 汽车油箱着火---用水浇灭 | D. | 森林起火---砍伐树木形成隔离带 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com