解:(1)设原混和物中碳酸钠的质量为x,生成NaCl的质量为y,参加反应的HCl为z
Na
2CO
3+2HCl═2NaCl+H
2O+CO
2↑
106 73 117 44
x z y 2.2g
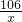
=
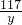
=
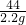
=
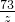
;
解得:x=5.3g,y=5.85g,z=3.65g
则碳酸钠的质量分数为:
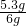
×100%═88.3%
(2)设配制上述反应所需用量的10%的稀盐酸,需溶质质量分数为37%、密度为1.18g/cm
3的浓盐酸的体积为a,则a×1.18g/cm
3×37%=3.65g
则a=8.36ml
(3)参加反应的盐酸溶液的质量为:
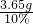
=36.5g.
反应后的溶质质量为:反应生成的氯化钠加上样品中原来有的氯化钠,样品中原有的氯化钠质量为:6-5.3=0.7g,反应生成的氯化钠为:5.85g
则溶质的质量为:5.85+0.7=6.55g
根据质量守恒定律,溶液的质量为:36.5g+5.3g-2.2g=39.6g
则溶质的质量分数为:
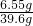
×100%
答:纯碱样品中碳酸钠的质量分数88.3%,配制上述反应所需用量的10%的稀盐酸,需溶质质量分数为37%、密度为1.18g/cm
3的浓盐酸的体积为8.36ml,
所得氯化钠溶液的溶质质量分数为
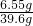
×100%
分析:(1)根据二氧化碳的质量以及碳酸钠与盐酸反应的方程式,列比例式即可求得参加反应的碳酸钠的质量以及反应生成的氯化钠的质量;
(2)根据碳酸钠与盐酸反应的化学方程式计算出所需HCl的质量,然后计算出浓盐酸的体积.
(3)由(1)求得反应生成的氯化钠的质量,则氯化钠的总质量为反应生成的氯化钠加上样品中原来有的氯化钠;
根据质量守恒定律求得反应后溶液的质量;再根据溶质质量分数=
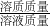
×100%即可求得反应后所得氯化钠溶液的溶质质量分数.
点评:本题考查学生利用化学反应方程式的计算,利用二氧化碳的质量代入计算是关键,学生还应熟悉质量分数的计算.

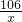 =
=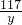 =
=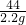 =
=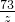 ;
;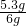 ×100%═88.3%
×100%═88.3%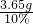 =36.5g.
=36.5g.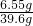 ×100%
×100%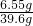 ×100%
×100%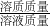 ×100%即可求得反应后所得氯化钠溶液的溶质质量分数.
×100%即可求得反应后所得氯化钠溶液的溶质质量分数.

 名校课堂系列答案
名校课堂系列答案