
鸡蛋壳的主要成分是碳酸钙。某学生想测定鸡蛋壳中碳酸钙的质量分数,取15g干燥的碎鸡蛋壳放入烧杯中,向其中加入了40g稀盐酸恰好完全反应(假设鸡蛋壳中除碳酸钙外的其他成分都不溶于水,且不与稀盐酸反应),反应后烧杯中物质的总质量50.6g。计算鸡蛋壳中碳酸钙的质量分数(结果保留1位小数)。
66.7%
解析试题分析:根据质量守恒定律可知,反应前后物质的总质量不变。
反应前物质的总质量为:15g(干燥的碎鸡蛋壳)+40g(稀盐酸)=55g而反应后烧杯中物质的总质量50.6g,这说明反应过程中生成了55g-50.6g=4.4 g的气体。此气体为二氧化碳。因此在反应中知道了二氧化碳的质量为4.4 g,可求出参加反应的碳酸钙的质量。然后再求出碳酸钙在鸡蛋壳中所占的质量分数。
解:生成二氧化碳的质量为:40g+15g-50.6g = 4.4g
设15g鸡蛋壳中碳酸钙的质量为x。
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
100 44  4.4g
4.4g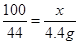
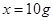
鸡蛋壳中碳酸钙的质量分数为: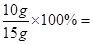 66.7%
66.7%
答:鸡蛋壳中碳酸钙的质量分数为66.7%
考点:根据化学方程式的计算


科目:初中化学 来源: 题型:计算题
(3分)过氧化钠(Na2O2)是一种供氧剂,与水反应的化学方程式为2Na2O2+2H2O===4NaOH+O2↑。将一定量的Na2O2加入到87.6g水中,完全反应后所得溶液的质量比反应物的总质量减少了3.2g(水的挥发忽略不计)。请计算:
(1)生成氧气的质量为_____g。
(2)反应后所得溶液中溶质的质量。
(3)将所得溶液稀释成溶质的质量分数为10%的溶液,需加水的质量。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
我国是世界钢铁产量最大的国家,炼铁的主要原料是铁矿石。用赤铁矿石(主要成分为Fe2O3)炼铁的反应原理为: 3CO+Fe2O3 2Fe+3CO2。
2Fe+3CO2。
(1)求Fe2O3中铁元素的质量分数。
(2)根据化学方程式计算:用含Fe2O360%的赤铁矿石800 t,理论上可炼出纯铁多少吨?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
将24.1 g由NaCl和BaCl2组成的固体混合物溶解于99.2 mL水 中(ρ水 ="1" g/ cm3),向所得溶液中滴加质量分数为14.2 %的Na2SO4溶液,至恰好完全反应。 所加Na2SO4溶液质量与生成沉淀质量的关系如图,计算:
(1)生成沉淀的质量是多少?
(2)反应后所得溶液中溶质的质量分数为多少?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某石灰石样品的成分是CaCO3和SiO2(已知SiO2既不溶于水也不与盐酸反应)。课外小组为了测定该石灰石样品中碳酸钙的质量分数,将12.0g石灰石样品放入烧杯中,再取100 g稀盐酸分4次加入烧杯中,每次均充分反应。实验数据记录如下:
| 次 数 | 第1次 | 第2次 | 第3次 | 第4次 |
| 加入稀盐酸质量 /g | 25 | 25 | 25 | 25 |
| 反应后烧杯中物质的总质量 /g | m | 58.4 | 82.6 | 107.6 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
在46.5g硫酸钠和氯化钠组成的混合物中,加入72.8g水,再加入104g溶质质量分数为20%的氯化钡溶液恰好完全反应,滤出沉淀(过滤时损耗不计),求:
(1)原混合物中硫酸钠的质量;
(2)反应后所得溶液中溶质的质量分数.
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某学生用足量的一氧化碳还原10g赤铁矿石(主要成分为氧化铁,所含杂质为不参加反应的固体物质),充分反应后,称量剩余固体质量为7.6g,
请回答下列问题:
(1)氧化铁中铁元素的质量分数为 ;
(2)计算赤铁矿石中氧化铁的质量,写出一氧化碳还原氧化铁反应的化学方程式和必要的计算过程。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
金属生锈会增加零件间的磨损,甚至造成火灾、爆炸等灾难性事故。某工厂为了减轻机械的锈蚀带来的损失,用盐酸(HCl)除铁锈(Fe2O3),已知发生反应的方程式为Fe2O3+6HCl=2FeCl3+3H2O,求:
若此次除铁锈结束后,生成了151.2g水,则此次除去铁锈的质量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com