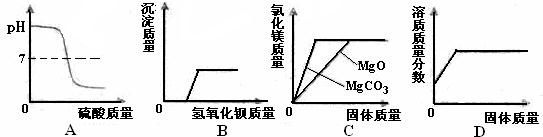
分析:A、氢氧化钠溶液呈碱性,而硫酸为酸性,所以起始的溶液的pH值大于7,而加入稀硫酸过量后的溶液的pH值小于7,可以据此解答该题;
B、氢氧化钡溶液和硫酸以及硫酸镁都能生成难溶于水且难溶于酸的沉淀,可以据此解答该题;
C、根据氧化镁和碳酸镁与盐酸反应的化学方程式完成解答;
D、根据饱和溶液和溶液的组成进行解答.
解答:解:A、氢氧化钠溶液呈碱性,而硫酸为酸性,所以起始的溶液的pH值大于7,而加入稀硫酸过量后的溶液的pH值小于7,故A图象正确;
B、氢氧化钡溶液和硫酸以及硫酸镁都能生成难溶于水且难溶于酸的沉淀,所以加入混合溶液即产生沉淀,故B图象错误;
C、由题意,因为盐酸质量相同,假设为1克,则生成氯化镁的质量都为73g
MgO+2HCl═MgCl2+H2O;MgCO3+2HCl═MgCl2+H2O+CO2↑
40 73 95 84 73 95
根据上述关系可以知道生成的氯化镁的质量相等,但是消耗的固体的质量明显是碳酸镁要多,故C图象错误;
D、在一定温度下,向饱和的硝酸钠溶液中不断加入硝酸钠固体,由于硝酸钠已处于饱和状态,所以不能继续溶解,其溶液的溶质的质量分数也不再改变,故D图象错误.
故选A.
点评:了解实验数据的处理或者误差分析的方法及技巧;掌握酸的化学性质和中和反应及其应用;了解溶液的酸碱性与PH值的关系.



 阅读快车系列答案
阅读快车系列答案