
【题目】五氧化二钒(V2O5)广泛用于化工行业。工业上的钒废催化剂主要含硫酸氧钒(VOSO4)和少量的 K2SO4、SiO2 杂质,现要除去杂质并得到 V2O5 固体,其流程如下:
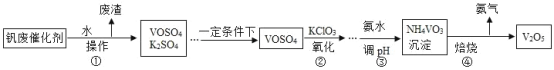
(1)操作①的名称____________________________,废渣的主要成分是____________________________。
(2)农业上,K2SO4 可用作____________________________。
(3)25℃时,取样进行试验分析,得到 NH4VO3,沉淀率和溶液 pH 之间的关系如表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
NH4VO3沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
在以上流程中,步骤③中加入氨水调节溶液的最佳 pH 范围为____________________________。
(4)该工艺流程中可以循环利用的物质是____________________________。
(5)步骤④的另一产物是水,该步骤反应的化学方程式为_______________。
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】为测定某H2SO4溶液的溶质质量分数,现取200g硫酸溶液置于烧杯中,不断加入一定质量分数的BaCl2溶液,反应过程中杯中溶液的质量与加入BaCl2溶液的质量关系如图所示。请回答:

(1)反应生成沉淀的质量为_____g;在Q点时溶液中的离子为_____(用符号)。
(2)在反应过程中,杯中溶液的pH_____(填“变大”、“不变”或“变小”)。
(3)原硫酸溶液的溶质质量分数是多少_____?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
A | B | C | D | |
实验装置 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
排水法收集氢气 |
解释 | 集气瓶中的水:吸收放出的热 | 量简中的水:通过水体积的变化得出O2体积 | 集气瓶中的水:冷却溅落融熔物,防止集气瓶炸裂 | 集气瓶中的水:先将集气瓶内的空气排净,后便于观察H2何时收集满 |
A.AB.BC.CD.D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
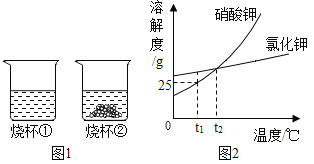
(1)烧杯②中的上层清液是否达到饱和状态?____(填“是”、“否”或“无法判断”);
(2)烧杯②中溶解的溶质是____(填化学式);
(3)t1℃时200g硝酸钾的饱和溶液中含有硝酸钾的质量为____g;
(4)关于图1 中烧杯内的物质,下列说法正确的是____。
A 烧杯①内溶液中溶质的质量分数<烧杯②内上层清液中溶质的质量分数
B 蒸发一定量的水,烧杯②一定有固体析出
C 将两个烧杯中的溶液混合,充分搅拌后,烧杯中可能还有氯化钾没有溶解
D 将温度升高到t2℃,烧杯②中固体一定全部溶解(不考虑水的蒸发)
E 将温度升高到t2℃,烧杯①内溶液的质量 = 烧杯②内溶液的质量(不考虑水的蒸发)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在“宏观—微观”之间建立联系 是化学独特的思维方式。下图甲、乙两物质间反应的微观示意图,有关说法错误的是( )

A. 反应的化学方程式为NaOH + NaHSO4 = Na2SO4 + H2O
B. 反应属于复分解反应
C. 反应的微观实质是H+和OH-结合成H2O
D. 反应前后的离子个数没有改变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图像中有关量的变化趋势与对应叙述关系正确的是
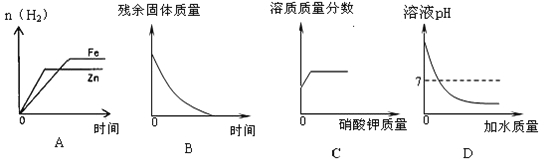
A.分别向质量相等的铁片和锌片中滴加稀硫酸
B.加热一定质量的高锰酸钾
C.某温度下,向一定质量的饱和硝酸钾中不断加入硝酸钾晶体
D.向一定质量的NaOH溶液中滴加水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属与人类生活密切相关。请分析回答下列问题:
(1)将黄铜片和纯铜片相互刻画,发现纯铜片表面留下较深的划痕,则它们的硬度大小关系是:黄铜____纯铜(填“>”“<”或"=”);
(2)工业用赤铁矿石炼铁的反应原理是:![]() ,该反应中体现了CO具有______性;为测定某赤铁矿石中氧化铁的质量分数,用足量的一氧化碳与10g样品充分反应(杂质不能反应),若反应后剩余固体质量为m克,写出计算该赤铁矿石中氧化铁质量分数的表达式_________(用m表示).
,该反应中体现了CO具有______性;为测定某赤铁矿石中氧化铁的质量分数,用足量的一氧化碳与10g样品充分反应(杂质不能反应),若反应后剩余固体质量为m克,写出计算该赤铁矿石中氧化铁质量分数的表达式_________(用m表示).
(3)往![]() 溶液中加入一定量锌和铜的混合粉末,充分反应后,过滤,滤液为蓝色,则滤液中可能含有的金属离子是______(写离子符号),滤渣中一定含有的金属是________(写金属名称),
溶液中加入一定量锌和铜的混合粉末,充分反应后,过滤,滤液为蓝色,则滤液中可能含有的金属离子是______(写离子符号),滤渣中一定含有的金属是________(写金属名称),
(4)稀土元素铕是激光和原子能应用的重要材料。已知三氯化铕的化学式为![]() ,则氧化铕的化学式为__________。
,则氧化铕的化学式为__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲和乙两种物质的溶解度曲线。
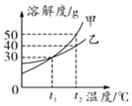
(1)t1℃时,将18g乙加入50g水中充分溶解,所得溶液为_____溶液。(填“饱和”或“不饱和”)
(2)t2℃时用相同质量的水配制甲和乙的饱和溶液,所需溶质质量的关系为甲_____乙。
(3)取t2℃时甲的饱和溶液90g,稀释为溶质质量分数为10%的溶液,需要加水的质量为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是X、Y、Z三种物质的溶解度曲线,下列说法正确的是( )
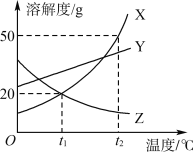
A. 随温度升高,X、Y、Z三种物质的溶解度不断增大
B. t2℃时,将50 g X加入50 g水中,充分搅拌后,所得溶液中溶质的质量分数为33.3%
C. 将t2℃时等质量的X、Y饱和溶液降温到t1℃,X溶液中析出的晶体质量小于Y
D. 将t1℃时X、Z的饱和溶液升温至t2℃,则Z溶液中溶质的质量分数减小,X溶液中溶质的质量分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com