
 如图是NaCl、MgSO4的溶解度曲线.下列说法正确的是
如图是NaCl、MgSO4的溶解度曲线.下列说法正确的是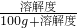 ×100%.
×100%.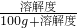 ×100%.所以硫酸镁在该温度的饱和溶液中溶质的质量分数大,故C正确;
×100%.所以硫酸镁在该温度的饱和溶液中溶质的质量分数大,故C正确;

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
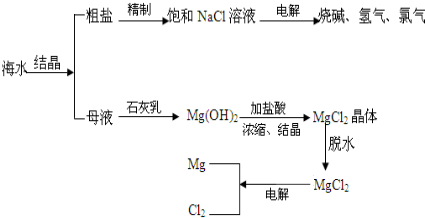
| 产品标准号:Q/JSRF0001S 准产证号:SD-013 配料表:精制食用盐 海藻碘 亚铁氰化钾 氯化钠(g/100g)≥98.00 海藻碘(以I计)/(mg/kg)18-33 亚铁氰化钾(以[Fe(CN)6]4-计)(mg/kg)≤10.0(2)提取金属镁:制取粗盐后的苦卤中含有丰富MgCl2等资源,如图是从苦卤中提取镁的简单流程:  上述流程中,试剂A通常用廉价的 Ca(OH)2 Ca(OH)2 (填化学式)悬浊液,沉淀B是Mg(OH)2 Mg(OH)2 ,试剂C为HCl HCl ,由无水MgCl2制取Mg的化学方程式为MgCl2
MgCl2 .
查看答案和解析>> 科目:初中化学 来源: 题型: (2013?荔湾区一模)某粗盐(主要成分是NaCl)样品中含有少量沙土、CaCl2和MgCl2杂质.以下是除去粗盐样品中杂质的实验流程,根据此流程图回答: 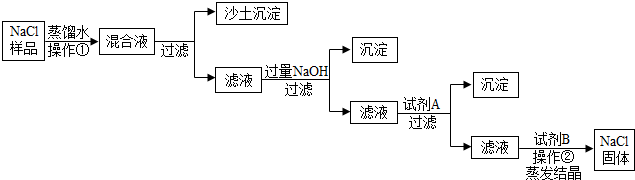 (1)操作①的名称是 溶解 溶解 .(2)加入NaOH目的是与滤液中MgCl2反应从而除去杂质.写出NaOH与MgCl2反应的化学方程式 2NaOH+MgCl2=Mg(OH)2↓+2NaCl 2NaOH+MgCl2=Mg(OH)2↓+2NaCl .(3)加入试剂A的目的是与滤液中的CaCl2反应.则加入试剂A后,沉淀是 CaCO3 CaCO3 . (4)本实验多次采用过滤操作,如图是过滤装置.过滤时,液体沿玻璃棒慢慢向漏斗中倾倒,注意液面始终要 低于滤纸 低于滤纸 边缘.(5)操作②蒸发结晶时用到的玻璃棒的作用是 搅拌,防止局部温度过高,造成液滴飞溅 搅拌,防止局部温度过高,造成液滴飞溅 .查看答案和解析>> 科目:初中化学 来源: 题型:阅读理解 纯碱是重要的化工原料 (一)制备探究:如图是工业生产纯碱的主要流程示意图. 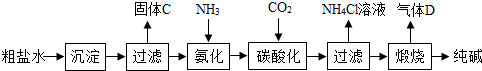 [查阅资料] ①粗盐水中含有杂质MgCl2、CaCl2; ②常温下,NH3极易溶于水,CO2能溶于水, ③NaHCO3加热易分解,Na2CO3加热不易分解. (1)写出除去粗盐水中MgCl2、CaCl2的化学方程式: MgCl2+2NaOH=Mg(OH)2↓+2NaCl MgCl2+2NaOH=Mg(OH)2↓+2NaCl ,CaCl2+Na2CO3=CaCO3↓+2NaCl CaCl2+Na2CO3=CaCO3↓+2NaCl (2)在工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是 有利于溶液吸收CO2气体 有利于溶液吸收CO2气体 ,“碳酸化”时,NaCl、NH3、CO2 和H2O相互作用析出NaHCO3,写出该反应的化学方程式NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl .(3)“碳酸化”后过滤获得的NH4Cl可用作 氮 氮 肥,也可先加热 加热 (填“加热”或“冷却”)NH4Cl溶液,再加入熟石灰获得循环使用的物质是NH3(或氨气) NH3(或氨气) ;(4)煅烧制得纯碱的化学方程式是 2NaHCO3
2NaHCO3
(二)成分探究 [提出问题]纯碱样品中含有哪些杂质? [猜想]猜想一:可能含有NaHCO3; 猜想二:可能含有NaCl; 猜想三: NaHCO3和NaCl NaHCO3和NaCl [实验探究]确定纯碱中是否含NaHCO3.实验装置和主要实验步骤如下: 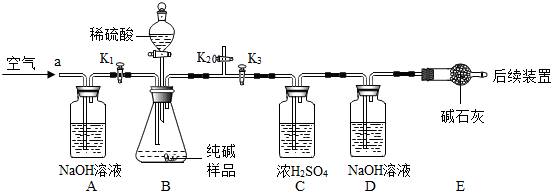 ①称量D、E装置总质量为200.0g,将10.6 0g纯碱试样放入锥形瓶中,按上图组装后打开活塞K1和K2,关闭K3,缓缓鼓入一段时间空气; ②关闭活塞K1和K2,打开K3,加入足量稀硫酸,待锥形瓶中不再产生气泡时,再次打开止水夹K1,从导管a处再次缓缓鼓入空气; ③一段时间后再次称量装置D、E的总质量为204.84g. [实验讨论] (5)加入样品前还应 检查装置气密性 检查装置气密性 ;(6)装置A的作用是 除去空气中的二氧化碳 除去空气中的二氧化碳 ,装置C的作用是除去二氧化碳中的水 除去二氧化碳中的水 ;装置E的作用是吸收从D中带出的水 吸收从D中带出的水 ;(7)反应结束后打开止水夹K1,缓缓鼓入空气的目的是 将生成的二氧化碳全部送到D中 将生成的二氧化碳全部送到D中 ,装置B中一定发生的化学反应方程式为Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 装置D中的化学反应方程式为CO2+2NaOH=Na2CO3+H2O CO2+2NaOH=Na2CO3+H2O .(8)装置B中生成CO2的质量为 4.84 4.84 g.通过计算说明纯碱中A A 含NaHCO3(填字母).A.一定 B.一定不 C.可能 D.无法确定 计算过程(已知Na2CO3相对分子质量为106、NaHCO3相对分子质量为84): 假设10.6g样品全为碳酸钠,生成二氧化碳的质量为x Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 106 44 10.6g x
x=4.4g 4.4g<4.84g 所以样品中含有碳酸氢钠. 假设10.6g样品全为碳酸钠,生成二氧化碳的质量为x Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 106 44 10.6g x
x=4.4g 4.4g<4.84g 所以样品中含有碳酸氢钠. (9)另取10.6样品,加入a g 14.6%的盐酸恰好完全反应,再将所得溶液蒸干后得到固体的质量为W,当W的值满足 W>0.32a W>0.32a 条件时,样品中含有NaCl.查看答案和解析>> 科目:初中化学 来源: 题型: 如图是某加碘食盐包装袋上的部分文字.
(1)20g样品中碘酸钾的质量; (2)样品中碘元素的质量,并判断样品中碘元素的含量是否符合标签要求. 查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |